Cálculos
de Concentração, Diluição, Cinética, Termoquímica e Eletroquímica
CONCENTRAÇÃO
DAS SOLUÇÕES
(ENEM 2022) O ácido tartárico é o
principal ácido do vinho e está diretamente relacionado com sua qualidade. Na
avaliação de um vinho branco em produção, uma analista neutralizou uma alíquota
de 25,0 mL do vinho com NaOH a 0,10 mol L-1, consumindo um volume
igual a 8,0 mL dessa base. A reação para esse processo de titulação é
representada pela equação química
C4H6O6 +
2NaOH => Na2C4H6O6 +
2 H2O
Massa
molar do ácido tartárico (C4H6O6) = 150g / mol
A
concentração de ácido tartárico no vinho analisado é mais próxima de:
A) 1,8 g L-1
B) 2,4 g L-1 C) 3,6
g L-1 D) 4,8 g L-1 E) 9,6
g L-1
Resolução
Vamos calcular a quantidade, em
mols, de NaOH usada para neutralizar 25 mL do ácido e depois passar para 1.000
mL ou 1 litro, que é o solicitado como resposta.
Leitura molar do NaOH: 0,10 mol L-1,
significa que cada litro (1.000 mL) desta solução contém 0,10 mols de NaOH.
Cálculo de quantos a mols foram
gastos ao usar 8,0 mL de solução aquosa de NaOH.
0,10 mol ................ 1.000mL
X mols ................... 8,0 mL
X = 0,0008 mols de NaOH foram gastos
para neutralizar 25 mL do ácido
Leitura da equação: 2 mols de Hidróxido de sódio
(NaOH) neutralizará 1 mol (150 gramas) de ácido tartárico.
2 mols (NaOH) ...............
150g (ácido)
0,0008 mols (NaOH) ....... X
g(ácido)
X = 0,06 gramas de ácido, que está
contido em 25 mL de solução, foram neutralizados.
A concentração pedida é em
gramas/litro, logo vamos calcular a quantidade de gramas em 1 litro ou 1.000 mL
de solução.
0,06 g ............. 25 mL
X g ................ 1.000mL
X = 2,4 gramas, que estão
dissolvidas em 1 litro de solução
Concentração = 2,4
gramas/litro ou 2,4 g L-1
Resposta: letra B
(ENEM 2022) O etanol é um combustível
produzido a partir da fermentação da sacarose presente no caldo de
cana-de-açúcar. Um dos fatores que afeta a produção desse álcool é o grau de
deterioração da sacarose, que se inicia após o corte, por causa da ação de
microrganismos. Foram analisadas cinco amostras de diferentes tipos de
cana-de-açúcar e cada uma recebeu um código de identificação.
No quadro são apresentados os dados de concentração de sacarose e de
microrganismos presentes nessas amostras.
Amostras de cana-de-açúcar
RB72 RB84
RB92
SP79 SP80
Concentração inicial de
sacarose (g.L-1)
13,0 18,0
16,0
14,0 17,0
Concentração de microrganismos
(mg.L-1)
0,7 0,8
0,6
0,5 0,9
Pretende-se escolher o tipo de cana-de-açúcar que conterá o maior
teor de sacarose 10 horas após o corte e que, consequentemente, produzirá a
maior quantidade de etanol por fermentação.
Considere
que existe uma redução de aproximadamente 50% da concentração de sacarose nesse
tempo, para cada 1,0 mg.L-1 de microrganismos presentes na
cana-de-açúcar.
Qual tipo de cana-de-açúcar
deve ser escolhido?
A) RB72 B) RB84 C) RB92 D) SP79 E) SP80
Resolução
Tipo de cana-de-açúcar a ser
escolhido é o de maior teor de sacarose, que significa maior concentração, em
gramas/litro, de sacarose que não foi deteriorada pelo microrganismo.
Concentração de sacarose restante após degradação
1mg/L de microrganismo terá 50% de sacarose degradada e 50% de sacarose não degradada.
Cálculo para 0,7 mg/L de
microrganismo
1mg/L ............ 50%
0,7mg/L ......... X
X= 0,7 x 50 = 35%,
observe que é só multiplicar o valor da concentração do microrganismo por 50%, e teremos o quando de sacarose será degradada.
RB72 => 0,7mg/L ....................
35%, logo 65% não degrada
RB84 => 0,8mg/L ....................
40%, logo 60% não degrada
RB92 => 0,6 mg/L ...................
30%, logo 70% não degrada
SP79 => 0,5mg/L ....................
25%, logo 75% não degrada
SP80 => 0,9 mg/L ...................
45%, logo 55% não degrada
Cálculo de quanto será a
concentração de sacarose, não degradada.
RB72 => 65% de 13,0 = 8,45
RB84 => 60% de 18,0 = 10,8
RB92 => 70% de 16,0 = 11,2 =>
maior concentração de sacarose, deve ser a amostra escolhida.
SP79 => 75% de 14,0 = 10,5
SP80 => 55% de 17,0 = 9,35
Resposta: letra C
(ENEM 2019/PPL) O vinagre é um produto alimentício resultante da
fermentação do vinho que, de acordo com a legislação nacional, deve apresentar
um teor mínimo de ácido acético (CH3COOH) de 4%
(v/v). Uma empresa está desenvolvendo um kit
para que a inspeção sanitária seja capaz
de determinar se alíquotas de 1mL de amostras de vinagre estão de acordo com a
legislação. Esse kit é composto por uma ampola
que contém uma solução aquosa de
Ca(OH)2 com 0,1 mol L-1
e um indicador que faz com que a solução fique cor-de-rosa, se
estiver básica, e incolor, se estiver neutra ou ácida.
Considere a densidade do ácido acético igual a 1,10 g cm-3, a massa molar do ácido
acético igual a 60g mol-1 e a massa molar do hidróxido de cálcio igual a 74g mol-1.
Qual é
o valor mais próximo para o volume de solução de Ca(OH)2, em mL, que deve estar contido em cada ampola do kit
para garantir a determinação da regularidade da amostra testada?
A) 3,7 B) 6,6 C) 7,3 D) 25 E) 36
Resolução
Teoria da reação de neutralização ácido/base: quantidades iguais (em mols) de cátions hidrogênio(H1+) e ânions hidroxila (OH1-) se neutralizam totalmente.
[CH3COOH]: apresenta um hidrogênio ionizável.
[Ca(OH)2]: apresenta duas hidroxilas dissociáveis.
Logo 1 mol (74 gramas) de Ca(OH)2 neutralizará 2 mols (2 x 60 gramas) de CH3COOH.
Usando a densidade do ácido acético e sua porcentagem (v/v) poderemos calcular a massa de ácido acético neutralizada.
Leitura percentual: o vinagre com teor mínimo de ácido acético (CH3COOH) de 4% (v/v): (volume/volume), significa que 100 mililitros de uma solução aquosa de vinagre tem 4 mililitros de ácido acético dissolvidos.
Leitura da densidade: densidade do ácido acético igual a 1,10 g cm-3, significa que um centímetro cúbico ou um mililitro (1mL) de ácido acético terá massa igual a 1,10 gramas. Massa de ácido deve corresponder a 4 mililitros, ou seja, (4x1,1 gramas = 4,4 gramas)
Leitura da concentração: solução aquosa de Ca(OH)2 com 0,1 mol L-1, significa que 0,1 mol de Ca(OH)2 esta dissolvido em 1 litro (1.000 mililitros) de solução.
Teoria da neutralização: 1 mol (74 gramas) de Ca(OH)2 neutralizará 2 mols (2 x 60 gramas) de CH3COOH.
A massa de ácido neutralizada é igual a 4,4 gramas e calculando quanto mols de Ca(OH)2 foram usados poderemos tirar o volume pela leitura da concentração.
120 g (CH3COOH) .............. 1 mol [Ca(OH)2]
4,4 g (CH3COOH)
............... x mols
X = 0,037 mols de [Ca(OH)2] foram neutralizados
Cálculo do volume de [Ca(OH)2] usado nesta neutralização.
Pela leitura da concentração temos: 0,1 mol de Ca(OH)2 esta dissolvido em 1 litro (1.000 mililitros) de solução.
0,1 mol ................ 1.000 mL
0,037 mol .............. x mL
X = 3,7 mL
Resposta: letra A
(ENEM 2016) Para cada litro de etanol
produzido em uma indústria de cana-de-açúcar são gerados cerca de 18 L de
vinhaça que é utilizada na irrigação das plantações de cana-de-açúcar, já que
contém teores médios de nutrientes N, P e K iguais a 357 mg/L, 60 mg/L e 2.034
mg/L, respectivamente. Na produção de 27.000 L de etanol, a quantidade total de
fósforo, em kg, disponível na vinhaça será mais próxima de
A) 1 B) 29 C) 60 D) 170 E) 1.000
Resolução
Cálculo do volume de linhaça em 27.000 litros de etanol.
1 L(etanol) ............ 18 L(linhaça)
27.000 L ............... x
x = 486.000 L
Concentração de fósforo(P) na linhaça: 60 mg/L, significa que em um litro de linhaça teremos dissolvidos 60 miligramas de fósforo (P).
60 mg .............. 1 L
x mg ................ 486.000 L
x = 29.160.000 mg
1 kg ........... 1.000.000 mg
X kg ........... 29.160.000 mg
x = 29,16 kg
Resposta: letra B
(ENEM
2016 - 2da aplicação) O soro fisiológico é uma solução aquosa de
cloreto de sódio (NaCl) comumente utilizada para higienização ocular, nasal, de ferimentos e
de lentes de contato. Sua concentração é 0,90%, em massa e densidade igual a
1,00 g/mL.
Qual massa de NaCl, em grama, deverá ser adicionada à água para
preparar 500 mL desse soro?
A) 0,45 B) 0,90 C) 4,50 D) 9,00 E) 45,00
Resolução
Leitura percentual: 0,90%, em massa: significa que a cada 100 gramas de soro teremos 0,90 gramas de cloreto de sódio.
Densidade 1,00 gramas/mililitro: significa que cada mililitro de soro tem massa igual a 1 grama.
Pergunta: Qual a massa de NaCl, em gramas, deverá ser adicionada à água para preparar 500 mL desse soro?
Pela densidade, igual a 1,0g/mL, temos que 500 mililitros de soro tem massa igual a 500 gramas.
Cada 100 gramas de soro apresenta 0,90 gramas de NaCl, logo em 500 gramas de soro teremos cinco vezes mais NaCl, ou seja 4,5 gramas.
Resposta: letra C
Resolução por transformação de unidades
(ENEM
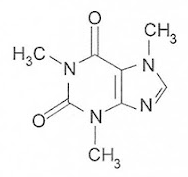
2015 - 2da aplicação) A cafeína é um alcaloide,
identificado como 1,3,7 – trimetilxantina (massa molar igual a 194 g/mol),
cuja estrutura química contém uma unidade de purina, conforme representado.
Esse alcaloide é encontrado em grande quantidade nas sementes de café e nas
folhas de chá-verde. Uma xícara de café contém, em média, 80 mg de cafeína.
Considerando que a xícara descrita contém um volume de 200 mL de café, a concentração, em mol/L, de cafeína nessa xícara é mais próxima de
a) 0,0004 b) 0,002 c) 0,4 d) 2 e) 4
1. Por regra de três tradicional
Cálculo da massa 80 miligramas ( 0,08 gramas) em mols.
1 mol ...................... 194 g
x mol ...................... 0,08g
x = 0,00041 gramas
Cálculo da concentração molar.
0,00041 g .................... 200 mL
x gramas ..................... 1.000 mL
x = 0,002 mol/litro
2. Resolução por análise dimensional
Resposta: letra B
(ENEM
2015 - 2da aplicação) O vinagre vem sendo usado
desde a Antiguidade como conservante de alimentos, bem como agente de limpeza e
condimento. Um dos principais componentes do vinagre é o ácido acético (massa
molar 60g/mol), cuja faixa de concentração deve se situar entre 4% a 6% (m/v).
Em um teste de controle de qualidade foram analisadas cinco marcas de
diferentes vinagres, e as concentrações de ácido acético, em mol/L, se
encontram no quadro.
Amostra Concentração de ácido acético (mol/L)
1 0,007
2
0,070
3
0,150
4
0,400
5
0,700
A amostra de vinagre que se encontra dento do limite de concentração tolerado é a
a) 1 b) 2 c) 3 d) 4 e) 5
Leitura percentual: 4% (m/v) = 4 gramas de ácido acético por 100 mL de vinagre.
Leitura percentual: 6 % (m/v) = 6 gramas de ácido acético por 100 mL de vinagre.
Resolução por transformação de unidades
Resposta: letra E
(ENEM 2014 - 2da aplicação) O álcool comercial (solução de
etanol mais água) é vendido na concentração de 96%, em volume. Entretanto, para
que possa ser utilizado como desinfetante, deve-se usar uma solução alcoólica
na concentração de 70%, em volume.
Suponha que um hospital recebeu como doação um lote de 1.000 litros de álcool
comercial 96%, em volume, e pretende trocá-lo por um lote de álcool
desinfetante.
Para que a quantidade total de etanol seja a mesma nos dois lotes, o volume de álcool 70% fornecido na troca deve ser mais próximo de
Resolução
Cálculo da quantidade de etanol presente nos 1.000 litros de álcool comercial a 96%
Leitura percentual: álcool comercial 96% corresponde a 96 litros de etanol em 100 litros de álcool comercial
Por regra de três tradicional
álcool comercial etanol
100 L ....................... 96L
1.000L ..................... x L
x = 960 L
Cálculo do
volume de álcool comercial a 70% que contém 960 litros de etanol
Leitura percentual: álcool comercial 70% corresponde a 70 litros de etanol em 100 litros de álcool comercial a 70%
Por regra de três tradicional
Álcool comercial etanol
100 L ....................... 70 L
x L .......................... 960 L
x = 1371 L
Resposta: letra B
Resolução por regra de três inversa: baseada na teoria que para diminuir a concentração da solução o volume de solvente deve aumentar e com isso aumentando o volume final da solução.
1.000L ................. 96%
x L
....................... 70%
70 . x = 96 . 1.000
x = 1.371 L
Resolução por transformação de unidades
Legenda: álcool comercial a 70% = a.c.70% e álcool comercial a 96% = a.c.96%
(ENEM
2012/PPL) O
quadro apresenta o teor de cafeína em diferentes bebidas comumente consumidas
pela população.
Bebida Volume (mL) Quantidade média de cafeína (mg)
Café
expresso
80,0
120
Café filtrado 50,0 35
Chá preto 180,0 45
Refrigerante de cola 250,0 80
Chocolate quente 60,0 25
Da análise do quadro conclui-se que o menor teor de cafeína por unidade de volume está presente no
a) café expresso b) café filtrado c) chá preto
d) refrigerante de cola e) chocolate quente
ENEM
2010) Ao colocar um pouco de açúcar na água e mexer até a obtenção
de uma só fase, prepara-se uma solução. O mesmo acontece ao se adicionar um
pouquinho de sal à água e misturar bem. Uma substância capaz de dissolver o
soluto é denominada solvente; por exemplo, a água é um solvente para o açúcar,
para o sal e para várias outras substâncias. Suponha que uma pessoas, para
adoçar seu cafezinho, tenha utilizado 3,42 gramas de sacarose (massa molar
igual a 342 g/mol) para uma xícara de 50 mL do líquido. Qual a concentração
final, em mol/L, de sacarose nesse cafezinho?
a)
0,02 b)
0,2 c)
2 d)
200 e) 2.000
Resolução
A pergunta é a concentração, em mol/litro
Cálculo da quantidade de mols
342gramas
............. 1 mol
3,42
gramas ........... x
X
= 0,01 mol
Cálculo do
volume, em litros.
1
litro ............. 1.000 mililitros
X
litros ........... 50 mililitros
X = 0,05 litros
Concentração,
em mol/litro: 0,01 mol / 0,05 litros = 0,2mol/litro
Resposta: letra B
(ENEM
2010) A
composição média de uma bateria automotiva esgotada é de aproximadamente 32%
Pb, 3% PbO, 17% PbO2 e 36% PbSO4. A média de massa
da pasta residual de uma bateria usada é de 6 Kg, onde 19% é PbO2,
60% PbSO4 e 21% Pb. Entre todos os compostos de chumbo
presentes na pasta, o que mais preocupa é o sulfato de chumbo (II), pois nos
processos pirometalúrgicos, em que compostos de chumbo (placas de bateria) são
fundidos, há a conversão de sulfato em dióxido de enxofre, gás muito poluente.
Para
reduzir o problema das emissões de SO2(g), a indústria pode utilizar
uma planta mista, ou seja, utilizar o processo hidrometalúrgico, para a
dessulfuração antes da fusão do composto de chumbo. Nesse caso, a redução de
sulfato presente no PbSO4 é feita via lixiviação com solução de
carbonato de sódio (Na2CO3) 1M a 45oC, em que
se obtém o carbonato de chumbo (II) com rendimento de 91%. Após esse processo,
o material segue para a fundição para obter o chumbo metálico.
PbSO4 + Na2CO3 => PbCO3 + Na2SO4
Dados: Massas molares em g/mol: Pb = 207; S = 32; Na = 23; O = 16; C = 12
Segundo as condições do processo apresentado para a obtenção de carbonato de chumbo (II) por meio da lixiviação por carbonato de sódio e considerando uma massa de pasta residual de uma bateria de 6 Kg, qual quantidade aproximada, em quilogramas, de PbCO3 é obtida?
a) 1,7 Kg b) 1,9 Kg c) 2,9 Kg d) 3,3Kg e) 3,6 Kg
Resolução
Cálculo das Massas molares
PbSO4 = (1 x
207) + (1 x 32) + (4 x 16) = 303g = 0,303 Kg
PbCO3 = (1 x 207) +
(1 x 12) + (3 x 16) = 267g = 0,267 Kg
60% da pasta residual é
de PbSO4 e com este dado poderemos calcular a massa
de PbCO3 usando a proporção da equação.
Cálculo da massa
de PbSO4 contida na pasta residual.
6kg(pasta) .................
100%
x kg (PbSO4)
.............. 60%
x = 3,6kg de PbSO4 existe
na pasta residual.
Leitura mássica da equação usando as massas molares: 0,3kg
de PbSO4 reagem e produzem 0,267kg de PbCO3.
3. Montando
a regra de três teremos:
0,3kg PbSO4 ....................
0,267 kg PbCO3
3,6kg PbSO4 .....................x
kg PbCO3
x = 3,3 kg de PbCO3 foi
obtida, considerando um rendimento de 100%, mas o teste diz que o rendimento
foi de 91%.
3,3kg ................... 100%
x kg ,,,,,,,,,,,,,,,,,,,,,. 91%
x = 2,9 kg aproximadamente
Resposta: letra C
(ENEM 2010 - 2da aplicação) Um litro de “água de lavanderia”
custa R$ 1,50. Sua densidade é de 1,0 Kg/litro e seu poder alvejante equivale a
uma solução aquosa com 3%, em massa, de cloro (Cl2). Calcule
quanto se deverá pagar para adquirir uma quantidade de tal produto que
corresponderia a um mol de Cl2.
Dado: massa
molar do cloro = 35,5g/mol)
A) R$ 3,55 B) R$ 2,81 C) R$ 28,1 D) R$ 35,5 E) R$ 1,78
Resolução
Leitura
percentual, em massa: 3%,
em massa, de cloro na “água de lavanderia” significa que em 1oo gramas de “água
de lavanderia” teremos 3 gramas de um produto que neste caso corresponde ao gás
cloro.
Cálculo da quantidade de “água de lavanderia” que corresponde a 1 mol de cloro ou 71 gramas.
Cl2 = (2 x 35,5) = 71 gramas/mol
3g Cl2 ................ 100 g de “agua de lavanderia”.
7g Cl2 ..............
x
x = 2.367 g
de “água de lavanderia”
Cálculo do
volume que esta massa calculada ocupa usando a densidade.
d = 1kg/L ou 1.000 g/L
1.000 g .................. 1 L
2.367 g
.................. x L
x = 2,367 L
Cálculo do
custo deste volume
1 L ............... R$ 1,5
2,367 L
........ x
x = 3,55 reais
(ENEM 2019) Glicólise é um processo que ocorre nas células, convertendo glicose em piruvato. Durante a prática de exercícios físicos que demandam grande quantidade de esforço, a glicose é completamente oxidada na presença de O2. Entretanto, em alguns casos, as células musculares podem sofrer um déficit de O2 e a glicose ser convertida em duas moléculas de ácido lático. As equações termoquímicas para a combustão da glicose e do ácido lático são, respectivamente, mostradas a seguir:
O processo anaeróbico é menos vantajoso energeticamente porque
A) libera 112 kJ por mol de glicose. B) libera 467 kJ por mol de glicose.
C) libera 2.688 kJ por mol de glicose. D) absorve 1.344 kJ por mol de glicose.
E) absorve 2.800 kJ por mol de glicose.
Resolução
Reação do processo anaeróbico é a conversão da glicose em ácido lático na ausência de oxigênio.
Equação da reação anaeróbica: C6H12O6(s) → 2CH3CH(OH)COOH(s)
Na reação I está representado 1 mol de glicose como reagente, igual a equação da reação anaeróbica, logo a entalpia envolvida será igual a −2.800 kJ
Na reação II está representado 1 mol de ácido lático como reagente, mas precisamos de 2 mols de ácido lático como produto, igual a equação da reação anaeróbica, logo precisamos inverter e multiplicar por dois a entalpia envolvida.
+1.344 x 2 kJ = +2.688 kJ
Balanço de energia: a soma das variações de entalpia resulta na energia envolvida na reação anaeróbica.
∆H = +2.688 + (-2.800) = - 112kJ
Resposta: letra A
(ENEM 2019/PPL) O gás hidrogênio é considerado um ótimo combustível — o único produto da combustão desse gás é o vapor de água, como mostrado na equação química.
Ligação química Energia de ligação (Kj/mol)
H−H 437
Massas molares (g/mol): H2 = 2; O2 = 32; H2O = 18.
Qual é a variação da entalpia, em quilojoule, da reação de combustão do hidrogênio contido no cilindro?
A) −242.000 B) −121.000 C) −2.500 D) +110.500 E) +234.000
Resolução
Energia de ligação: é a energia gasta para romper 1 mol de ligações de uma substância.
H2 => H−H = 437 kj/mol: significa que para romper 1 mol de ligações H – H serão necessários 437 quilojoules.
No caso da água (H2O = H – O – H) teremos 2 mols de ligações H - O, logo 2H-O => = 2x463 = 926 kj/mol: significa que para romper 2 mol de ligações H – O serão necessários 926 quilojoules.
Variação de Entalpia: será a soma das energias absorvidas (valor positivo) para quebrar ligações mais as energias liberadas (valor negativo) ao formar novas ligações.
Leitura da equação: 2H2(g) + O2(g) → 2H2O(g)
2 H2(g): teremos 2 mols de ligações H–H, e para romper deverá absorver 437x2 quilojoules.
O2(g): teremos 1 mol de ligações O = O, e para romper deverá absorver 494 quilojoules.
2H2O(g): cada mol de moléculas de água é formado por 2 mols de ligações H – O, como na reação teremos 2 mols de moléculas de água ao forma-las teremos liberação de 2 x 926 quilojoules.
Variação de entalpia: 874 + 494 + (-1852) = - 484 kj é a energia liberada na queima de 4 gramas de gás Hidrogênio, conforme equação dada (2H2), mas a queima foi de 1 quilograma ou 1.000 gramas, logo
4g ............ - 484 kj
1.000g ...... x kj
X = -121.000 kj
(ENEM 2016/1) O benzeno um importante solvente para a indústria química, é obtido industrialmente pela destilação do petróleo. Contudo, também pode ser sintetizado pela trimerização do acetileno catalisada por ferro metálico sob altas temperaturas, conforme a equação química:
3C2H2(g) => C6H6(l)
I. C2H2(g) + 5/2 A energia envolvida nesse processo pode ser calculada pela variação de entalpia das reações de combustão das substâncias participantes, nas mesmas condições experimentais:
O2(g) => 2 CO2(g) + H2O(l) ∆Hc = - 310 kcal/mol
II. C6H6(g) + 15/2 O2(g) => 6 CO2(g) + 3 H2O(l) ∆Hc = - 780 kcal/mol
A variação de entalpia do processo de trimerização, em kcal, para a formação de um mol de benzeno é mais próxima de
a) - 1.090 b) - 150 c) - 50 d) + 157 e) + 470
Resolução
Trimerização é o termo usado para representar 3 mols de substância, neste caso 3 mols de acetileno (C2H2) reagem e produzem 1 mol de benzeno (C6H6).
Na reação I está representado somente 1 mol de acetileno, mas o processo exige 3, logo vamos multiplicar todas as substâncias por 3 e a variação de entalpia também.
O benzeno será o produto da reação de trimerização e como na reação II ele está como reagente precisamos inverter a reação e o sinal da variação de entalpia também, pois a reação I indica o início e a reação II o fim do processo de trimerização.
Balanço de energia: a soma das variações de entalpia resulta na energia envolvida na trimerização.
∆Hfinal = ( - 310 x 3 ) + ( + 780 ) = - 150 kcal
Resposta: letra B
(ENEM 2016 - PPL) A obtenção de energia por meio da fissão nuclear do 235U é muito superior quando comparada à combustão da gasolina. O calor liberado na fissão do 235U é 8 x 1010J/g e na combustão da gasolina é 5 x 104J/g.
A massa de gasolina necessária para obter a mesma energia na fissão de 1 kg de 235U é da ordem de
a) 103 g b) 104 g c) 105 g d) 106 g e) 109 g
1. Por regra de três tradicional
Cálculo da energia gerada na fissão de 1 quilograma de urânio.
1 grama ..................... 8 x 1010J
1.000 gramas ................ x
x = 8 x 1013J
Cálculo da massa de gasolina que será queimada para produzir a mesma energia.
5 x 104J .................. 1 grama
8 x 1013J ................. x gramas
x = 1,6 x 109 gramas, logo a ordem de grande é 109
Resposta: letra E
(ENEM 2015) O aproveitamento de resíduos florestais vem se tornando cada dia mais atrativo, pois eles são uma fonte renovável de energia. A figura representa a queima de um bio-óleo extraído do resíduo da madeira, sendo ∆H1 a variação de entalpia devido à queima de 1 g desse bio-óleo, resultando em gás carbônico e água líquida, e ∆H2 a variação de entalpia envolvida na conversão de 1 g de água no estado gasoso para o estado líquido.
A variação de entalpia, em kJ para a queima de 5 g desse bio-óleo resultando em CO2 (gasoso) e H2O (gasoso) é:
a) – 106 b) – 94,0 c) – 82,0 d) – 21,2 e) – 16,4
Resolução
∆H1 = - 18,8 kJ/g é a energia liberada quando da formação de água líquida.
∆H2 = - 2,4 kJ/g é a energia liberada na passagem de água gasosa para água líquida. Observe que o estado físico do CO2 não mudou.
Logo ∆H1 - ∆H2: é a energia envolvida na combustão do bio-óleo formando água líquida que absorverá 2,4kJ para vaporizar e formar água gasosa .
∆H1 - ∆H2 = - 18,8 – (- 2,4) = - 16,4 kJ energia envolvida na queima de 1 g de bio-óleo
Por regra de três tradicional
1grama de bio-óleo ................ -16,4kj
gramas de bio-óleo ............... X
X = - 82 kj
(ENEM 2015/2) O urânio é um elemento cujos átomos contém 92 prótons, 92 elétrons e entre 135 e 148 nêutrons. O isótopo de urânio 235U é utilizado como combustível em usinas nucleares, onde, ao ser bombardeado por nêutrons, sofre fissão de seu núcleo e libera uma grande quantidade de energia (2,35 x 1010 kJ/mol). O isótopo 235U ocorre naturalmente em minérios de urânio, com concentração de apenas 0,7%. Para ser utilizado na geração de energia nuclear, o minério é submetido a um processo de enriquecimento, visando aumentar a concentração do isótopo 235U para, aproximadamente, 3% nas pastilhas.
Em décadas anteriores, houve um movimento mundial para aumentar a geração de energia nuclear buscando substituir, parcialmente, a geração de energia elétrica a partir da queima de carvão, o que diminui a emissão atmosférica de CO2 (gás com massa molar igual a 44g/mol).
A queima do carvão é representada pela equação química:
C(s) + O2(g) => CO2(g) DH = - 400kJ/mol
Qual a massa de CO2, em toneladas, que deixa de ser liberada na atmosfera, para cada 100 g de pastilhas de urânio enriquecido utilizadas em substituição ao carvão como fonte de energia?
a) 2,1 b) 7,70 c) 9,0 d) 33,0 e) 300
Resolução
Por regra de três tradicional
a. Cálculo da quantidade de urânio por pastilha
Leitura percentual: 3%: cada 100 gramas de pastilhas contém 3 gramas de urânio 235
b. Cálculo da energia liberada quando usamos 3 gramas de urânio 235
Lembrando que: 2,35 x 1010 kJ/mol U = 2,35 x 1010 kJ / 235gramas
Energia ..................... gramas de urânio
2,35 x 1010 kJ ................ 235 g
x kJ ................................ 3 g
x = 3 x 108 kJ
c. Cálculo da massa de carbono, em toneladas, para produzir a mesma energia
Lembrando que: 400 kJ/mol Carbono = 400 kJ/ 44 gramas de Carbono e que 1 tonelada = 106 gramas
44 g ............................... 400 kJ
X g ................................. 3 x 108 kJ
X = 33 x 106 gramas = 33 toneladas
Resposta: letra D
(ENEM 2009) Vários combustíveis alternativos estão sendo procurados para reduzir a demanda por combustíveis fósseis, cuja queima prejudica o meio ambiente devido à produção de dióxido de carbono (massa molar igual a 44g.mol-1). Três dos mais promissores combustíveis alternativos são o hidrogênio, o etanol e o metano. A queima de 1 mol de cada um desses combustíveis libera uma determinada quantidade de calor, que estão apresentadas na tabela a seguir.
Combustível Massa molar(g.mol-1) Calor liberado na queima (kj.mol-1)
H2 2 270
CH4 16 900
C2H5OH 46 1350
Considere que foram queimadas massas, independentemente, desses três combustíveis, de forma tal que em cada queima foram liberados 5.400 kj. O combustível mais econômico, ou seja, o que teve menor massa consumida, e o combustível mais poluente, que é aquele que produziu a maior massa de dióxido de carbono (massa molar igual a 44g.mol-1), foram respectivamente,
a) o etanol, que teve apenas 46 g de massa consumida, e o metano, que produziu 900 g de CO2.
b) o hidrogênio, que teve apenas 40 g de massa consumida, e o etanol, que produziu352 g de CO2.
c) o hidrogênio, que teve apenas 20 g de massa consumida, e o metano, que produziu 264 g de CO2.
d) o etanol, que teve apenas 96 g de massa consumida, e o metano, que produziu 176 g de CO2.
e) o hidrogênio, que teve apenas 2 g de massa consumida, e o etanol, que produziu 1350 g de CO2.
Resolução por transformação de unidades
Cálculo da massa consumida de cada combustível quando da liberação de 5.400 quilojoules.
Cálculo da massa de dióxido de carbono produzida. 
Resposta: letra B
CINÉTICA
QUÍMICA
(ENEM 2022) O elemento iodo (I) tem função biológica e é acumulado na tireoide. Nos acidentes nucleares de Chernobyl e Fukushima, ocorreu a liberação para a atmosfera do
radioisótopo 131I, responsável por
enfermidades nas pessoas que foram expostas a ele.
O decaimento de uma massa de 12 microgramas do isótopo 131I foi monitorado por 14 dias, conforme o quadro.
Tempo (dias): 0 2 4 5 6 8 14
Massa residual de 131I (μg): 12,0 10,1 8,5 7,8 7,2 6,0 3,6
Após o período de 40 dias, a massa residual desse isótopo é mais próxima de
A) 2,4 μg. B) 1,5 μg. C) 0,8 μg. D) 0,4 μg. E) 0,2 μg.
Resolução
Precisamos descobrir quanto tempo leva para que o decaimento mostre que metade da massa foi consumida (tempo de meia vida).
Observando o quadro verificamos que a
massa inicial era de 12 microgramas e após oito dias era de 6,0 microgramas,
logo o tempo de meia vida é de oito dias.
Meia vida igual a oito dias significa que a cada oito dias metade da massa foi consumida, logo em 40 dias teremos 5 meias vidas de oito dias.
Decaimento radioativo (meia-vida) após 5 meias-vidas.
1ra meia vida: 12μg decai para 6μg
2da meia vida: 6μg decai para 3μg
3ra meia vida: 3μg decaí para 1,5μg
5ta meia vida: 0,75μg decaí para 0,375μg
Resposta: letra D
(ENEM 2020) A sacarase (ou invertase) é uma enzima que atua no intestino humano hidrolisando o dissacarídeo sacarose nos monossacarídeos glicose e frutose. Em um estudo cinético da reação de hidrólise da sacarose (C12H22O11), foram dissolvidos 171 g de sacarose em 500 mL de água. Observou-se que, a cada 100 minutos de reação, a concentração de sacarose foi reduzida à metade, qualquer que fosse o momento escolhido como tempo inicial.
a) 2,50 × 10−3 mol L−1 b) 6,25 × 10−2 mol L−1 c) 1,25 × 10−1 mol L−1
d) 2,50 × 10−1 mol L−1 e) 4,27 × 10−1 mol L−1
Resolução
As afirmações das alternativas são em mol/litro, logo precisamos transformar os dados fornecidos em mol e litro.
Volume fornecido: 500 mililitros = meio litro = 0,5 litros
O dado de quantidade fornecido pelo teste foi 171 gramas, precisamos transformar para mols.
Massa molar da sacarose (C12H22O11)
(12x12) + (22x1) + (11x16) = 342 gramas por mol
1 mol
............ 342gramas
X mols
........... 171 gramas
X = 0,5 mol
Após os cálculos
verificamos que 0,5mol de sacarose estão dissolvidos em 0,5 litros de solução
ou 1 mol de sacarose esta dissolvido em 1 litro de solução.
No início teremos
1mol/litro de sacarose.
(Teste) Observou-se que, a cada 100
minutos de reação, a concentração de sacarose foi reduzida à metade, qualquer
que fosse o momento escolhido como tempo inicial.
Qual é a concentração de
sacarose depois de 400 minutos do início da reação de hidrólise?
Concentração inicial =
1,00mol/L
Após 100 minutos = 0,50
mol/L
Após 200 minutos = 0,25
mol/L
Após 300 minutos = 0,125
mol/L
Após 400 minutos =
0,0625 mol/L
Resposta: letra B
(ENEM 2017) A
técnica do Carbono-14 permite a datação de fósseis pelos valores de emissão
beta desse isótopo presente no fóssil. Para um ser em vida, o máximo são
15 emissões beta/(min.g). Após morte, a quantidade de carbono-14 se reduz
pela metade a cada 5730 anos. Considere que um fragmento fóssil de massa
igual a 30 gramas foi encontrado em sítio arqueológico, e a medição de radiação
apresentou 6.750 emissões beta por hora. A idade desse fóssil, em anos, é
a)
450 b) 1.433
c) 11.460
d)
17.190 e) 27.000
Resolução
Precisamos calcular a quantidade de emissões acontece por hora e considerando a
massa de 30 gramas.
Cálculo das emissões por hora ou 60 minutos.
15 emissões .........1 minuto
x emissões ........... 60 minutos
X = 900 emissões
Cálculo das emissões considerando massa de 30 gramas.
900 emissões ............... 1 gramas
x emissões ...................30 gramas
x = 27.000 emissões ocorrem por hora para uma massa de 30 gramas
Cálculo da idade do fóssil em anos.
Primeira meia vida: 27.000 emissões que após 5.730 anos se
reduz a metade, ou seja, 13.500 emissões.
Segunda meia vida: 13.500 emissões que após 5.730 anos se
reduz a metade, ou seja, 6.750 emissões, igual ao solicitado no teste.
Idade do fóssil em anos= 5730 + 5730 = 11.460 anos.
Resposta: letra C
(ENEM 2013) Glicose marcada com
nuclídeos de carbono-11 é utilizada na medicina para se obter imagens
tridimensionais do cérebro, por meio de tomografia de emissão de pósitrons. A
desintegração do carbono-11 gera um pósitron, com tempo de meia-vida de 20,4
min, de acordo com a equação da reação nuclear.
11C6 => 11B5 + 0e1
A partir da injeção de
glicose marcada com esse nuclídeo, o tempo de aquisição de uma imagem de tomografia
é de cinco meias-vidas.
Considerando que o
medicamento contém 1,00 g do carbono-11, a massa, em miligramas, do nuclídeo
restante, após a aquisição da imagem, é mais próxima de
a)
0,200 b)
0,969 c)
9,80 d)
31,3 e) 200
Resolução
Lembrando que 1,00
g = 1.000 mg
Decaimento radioativo
(meia-vida) após 5 meias-vidas.
1ra meia vida: 1.000 mg decai para
500 mg
2da meia vida: 500 mg decai para 250 mg
3ra meia vida: 250 mg decaí para 125 mg
4da meia vida: 125 mg decai para 62,5 mg
5ta meia vida: 62,5 mg decaí para 31,125 mg
Nuclídeo
restante = 31,125 mg aproximadamente 31,3
Resposta:
letra D
(ENEM
2009) O lixo radioativo ou nuclear é resultado da manipulação de materiais
radioativos, utilizados hoje na agricultura, na indústria, na medicina, em
pesquisas científicas, na produção de energia, etc. Embora a radioatividade se
reduza com o tempo, o processo de decaimento radioativo de alguns materiais
pode levar milhões de anos. Por isso, existe a necessidade de se fazer um
descarte adequado e controlado de resíduos dessa natureza. A taxa de decaimento
radioativo é medida em termos de um tempo característico, chamado meia-vida,
que é o tempo necessário para que uma amostra perca metade de sua
radioatividade original. O gráfico seguinte representa a taxa de decaimento
radioativo do rádio 226, elemento químico pertencente à família dos metais
alcalinos terrosos e que foi utilizado durante muito tempo na
medicina.
As informações
fornecidas mostram que após 3 meias vidas o consumo será igual a ............
da amostra original.
a) 0,500kg b)
0,250kg c)
0,125kg d)
0,875kg e) 0,725kg
Resolução
Decaimento radioativo
(meia-vida) após 3 meias vidas.
1ra meia
vida: 1 Kg decai para 1/2 Kg
2da meia
vida: 1/2 Kg decai para 1/4 Kg
3ra meia
vida: 1/4 Kg decaí para 1/8 Kg
Sobra
da amostra após 3 meias vidas: 1/8 Kg
Decaimento
ou consumo da amostra: 1 – 1/8 = 7/8 Kg = 0,875kg
Resposta letra: D
ELETROQUÍMICA
(ENEM 2016) TEXTO I : Biocélulas combustíveis são uma alternativa tecnológica para substituição das baterias convencionais. Em uma biocélula microbiológica, bactérias catalisam reações de oxidação de substratos orgânicos; Liberam elétrons produzidos na respiração celular para um eletrodo, onde fluem por um circuito externo até o cátodo do sistema, produzindo corrente elétrica. Uma reação típica que ocorre em biocélulas microbiológicas utiliza acetato como substrato.
TEXTO II: Em sistemas bioeletroquímicos, os potenciais padrão (Eo) apresentam valores característicos. Para as biocélulas de acetato, considere as seguintes semireações de redução e seus respectivos potenciais:
2 CO2 + 7 H+ + 8e => CH3COO- + 2 H2O Eo = -0,34 V
O2 + 4 H+ + 4e
=> 2H2O
Eo =
0,8 V
Nessas condições, qual é o número mínimo de biocélulas de acetato, ligadas em série, necessárias para se obter uma diferença de potencial de 4,4 V.
a) 3 b) 4 c) 6 d) 9 e) 15
Resolução
Sinônimos
de diferença de potencial (ddp): voltagem, tensão, potencial e força
eletromotriz (fem), são termos usados em eletroquímica para expressar a energia
elétrica gerada. O cálculo da ddp é simples: faz a diferença entre o maior e o
menor valor dos potenciais de oxidação ou os de redução, nunca um de oxidação e
outro de redução. Este valor deve ser sempre positivo, pois expressa a
espontaneidade do processo de geração de energia elétrica por oxidação-redução.
ddp = 0,80 – (-
0,34) = 1,1 V
Logo para obter
uma ddp de 4,4 V precisaremos de 4 biocélulas ligadas em série.
Resposta: letra B
(ENEM 2010)
A eletrólise é muito empregada na indústria com o objetivo de reaproveitar
parte dos metais sucateados. O cobre, por exemplo, é um dos metais com maior
rendimento no processo de eletrólise, com uma recuperação de aproximadamente
99,9%. Por ser um metal de alto valor comercial e de múltiplas aplicações, sua
recuperação torna-se viável economicamente.
Suponha que, em um processo de recuperação de cobre
puro, tenha-se eletrolisado uma solução de sulfato de cobre (II), [CuSO4],
durante 3 horas, empregando-se uma corrente elétrica de intensidade igual a
10A. A massa de cobre puro recuperada é de aproximadamente
Dados: Constante de Faraday – F = 96.500
C/mol;
Massa molar em g/mol: Cu = 63,5.
a) 0,02 g b) 0,04 g
c) 2,40 g d) 35,5 g e) 71,0 g
Resolução
Reação de formação do cobre metálico: 1Cu2+(aq) +
2 mols de elétrons => 1Cu(s)
Leitura molar: 1 mol de cátions cobre II, se reduzem, ao receber
2 mols de elétrons ( 2 . 96.500C) formando 1 mol de cobre metálico.
Coulombs é igual ao produto da amperagem pelo tempo
em segundo (Q = i . t)
Tempo, em segundos: 3 x 60 x 60 = 10.800 segundos
Coulombs = 10.800 s x 10 A = 108.000 C
A passagem de corrente elétrica reduz o cátion cobre II dissolvido na solução aquosa em cobre metálico insolúvel.
Resolução
1 mol Cu ............... 2x96.500C
x mol Cu ............... 108.000C
x = 0,56 mols
1mol Cu ................. 63,5gramas
0,56 mols Cu .............. x gramas
X = 35,55 gramas de cobre










Nenhum comentário:
Postar um comentário