01) O soro fisiológico é uma solução de cloreto de sódio a 0,9%. A quantidade, aproximada, em mol(s) de cloreto de sódio consumidos por um paciente que recebeu 1500 mL de soro fisiológico, é
Resumo teórico
Leitura percentual: 0,9% de cloreto de sódio no soro fisiológico significa que em 100gramas de soro temos 0,9gramas de cloreto de sódio.
Podemos considerar a densidade do soro igual a 1g/mL, pois a quantidade de cloreto de sódio misturada na água para formar o soro fisiológico é muito pequena e neste caso o volume será igual a massa.
Volume do soro = 1500mL = 1500gramas, pois pela densidade 1 grama é igual a 1 mililitro.
Calculando a massa de cloreto de sódio em 1500 gramas de soro poderemos depois transformar essa quantidade para mols.
Resolução do exercício
100g ................ 0,9g
1500g .............. X
X = 13,5gramas de cloreto de sódio
Leitura molar: 1mol de NaCl (23+35,5) tem massa igual a 58,5g.
1mol ................ 58,5g
xmol .............. 13,5g
x= 0,23mol
02) Qual a porcentagem, em massa, de uma solução de cloreto de sódio, cuja concentração é 116g/litro e sua densidade é 1,77g/mL.
02) Qual a porcentagem, em massa, de uma solução de cloreto de sódio, cuja concentração é 116g/litro e sua densidade é 1,77g/mL.
Resumo teórico
Leitura percentual: representa a massa, em gramas, de soluto em 100gramas de solução.
Leitura da concentração: 116g/litro significa que em um litro de solução temos 116gramas de soluto dissolvidos.
Leitura da densidade: cada mililitro de solução tem massa igual a 1,77gramas.
Precisamos transformar um litro de solução em massa.
Se cada mililitro de solução tem massa igual a 1,77gramas, 1litro ou 1000 mililitros terá uma massa 1000 vezes maior, ou seja, 1770gramas.
Leitura percentual: representa a massa, em gramas, de soluto em 100gramas de solução.
Leitura da concentração: 116g/litro significa que em um litro de solução temos 116gramas de soluto dissolvidos.
Leitura da densidade: cada mililitro de solução tem massa igual a 1,77gramas.
Precisamos transformar um litro de solução em massa.
Se cada mililitro de solução tem massa igual a 1,77gramas, 1litro ou 1000 mililitros terá uma massa 1000 vezes maior, ou seja, 1770gramas.
Resolução do exercício
1770 g de solução ................. 116gramas de soluto
100 gramas de solução .......... x g de soluto
x = 6,6gramas de soluto estão dissolvidos em 100gramas de solução.
x = 6,6%
1770 g de solução ................. 116gramas de soluto
100 gramas de solução .......... x g de soluto
x = 6,6gramas de soluto estão dissolvidos em 100gramas de solução.
x = 6,6%
03) Pesquisas mostram que a adição de 10mg de sulfato de ferro II em água potável suficiente para obter-se um litro de solução, diminui drasticamente a anemia em populações carentes. Nessa solução, a porcentagem em massa de sal é aproximadamente:
Resumo teórico
Leitura ponderal: porcentagem em massa representa a massa da substância, soluto, em 100gramas de solução.
1litro de solução é igual a 1kilograma, pois a quantidade de substância dissolvida é muito pequena e a densidade da solução é aproximadamente igual a 1.
Temos 10miligramas de sulfato de ferro III dissolvidas em 1000gramas(1Kg) de solução, logo em 100gramas de solução teremos 1miligrama ou 0,001grama.
Regra de três.
10mg (sulfato) ................ 1.000g (solução)
x mg (sulfato) ................. 100g (solução
x = 1 miligrama ou 0,001grama
Conclusão: temos 0,001grama de sulfato de ferro III dissolvidas em 100gramas de solução, logo a porcentagem é de 0,001%.
04) Calcule, com dois algarismos significativos, a porcentagem em massa do solvente, em uma solução de concentração igual a 34,2mol/litro de sacarose em água.
Massa específica da solução = 1,01g/mL.
Resumo teórico
Porcentagem em massa, do solvente: significa a massa, em gramas, de solvente em 100gramas de solução.
O objetivo é descobrir a massa de solvente na solução, logo se soubermos a massa da solução e a massa de soluto a diferença dará a massa de solvente.
Leitura da concentração: 34,2gramas/litro significa que em um litro de solução temos 34,2gramas de soluto.
Massa de soluto = 34,2gramas
Leitura da densidade: 1,01gramas por mililitro, significa que um mililitro de solução tem massa igual a 1,01gramas, como temos 34,2gramas de soluto em um litro de solução, se calcularmos a massa da solução em um litro a diferença nos dará a massa de solvente.
1litro é igual a 1000mililitros que é 1000vezes maior que 1milillitro, logo a massa também será 1000 vezes maior, ou seja 1010gramas.
Porcentagem em massa, do solvente: significa a massa, em gramas, de solvente em 100gramas de solução.
O objetivo é descobrir a massa de solvente na solução, logo se soubermos a massa da solução e a massa de soluto a diferença dará a massa de solvente.
Leitura da concentração: 34,2gramas/litro significa que em um litro de solução temos 34,2gramas de soluto.
Massa de soluto = 34,2gramas
Leitura da densidade: 1,01gramas por mililitro, significa que um mililitro de solução tem massa igual a 1,01gramas, como temos 34,2gramas de soluto em um litro de solução, se calcularmos a massa da solução em um litro a diferença nos dará a massa de solvente.
1litro é igual a 1000mililitros que é 1000vezes maior que 1milillitro, logo a massa também será 1000 vezes maior, ou seja 1010gramas.
Resolução do exercício
Massa de solvente = 1010 menos 34,2 = 975,8gramas
Cálculo da porcentagem, em massa , de solvente.
A palavra porcentagem significa uma quantidade em 100 partes, neste caso partes de solvente em 100 partes de solução.
1010g de solução ...................... 975,8gramas de solvente
100g de solução ........................ X gramas de solvente
x = 97g de solvente em 100gramas de solução
x = 97%
Massa de solvente = 1010 menos 34,2 = 975,8gramas
Cálculo da porcentagem, em massa , de solvente.
A palavra porcentagem significa uma quantidade em 100 partes, neste caso partes de solvente em 100 partes de solução.
1010g de solução ...................... 975,8gramas de solvente
100g de solução ........................ X gramas de solvente
x = 97g de solvente em 100gramas de solução
x = 97%
05) Um adoçante dietético é uma mistura de:
96,5% ................ Lactose
3,8% .................. Aspartame
0,6% .................. Dióxido de Silício
Um envelope com 1g de adoçante dietético tem na mistura quantos gramas de edulcorante artificial aspartame ?
Resumo teórico
Leitura ponderal (%): o adoçante dietético tem 3,8% de aspartame, o que significa 3,8gramas de aspartame por 100gramas de adoçante dietético, logo em cada 1grama de adoçante teremos 100 vezes menos de aspartame.
Relação: massa de adoçante (solução) e massa de aspartame (soluto).
Resolução do exercício
Adoçante ................... aspartame
100gramas ............... 3,8gramas
1grama ..................... x gramas
x = 0,038gramas

06) Que massa de uma solução a 4%, em massa, de cloreto de sódio é necessária para se obter 6,0 miligramas deste composto?
Resumo teórico
Leitura ponderal (%): 4% significa que em 100miligramas de solução temos 4miligramas de cloreto de sódio.
100 mg (solução) ........... 4mg (cloreto de sódio)
Leitura ponderal (%): 4% significa que em 100miligramas de solução temos 4miligramas de cloreto de sódio.
Resolução do exercício
100 mg (solução) ........... 4mg (cloreto de sódio)
X mg (solução ................ 6mg (cloreto de sódio)
07) Qual a massa de mercúrio, em quilogramas, que existe em 1 tonelada de cinábrio contendo 70% de sulfeto de mercúrio II.
Resumo teórico
Leitura percentual: 70% de sulfeto de mercúrio II no cinábrio significa que cada 100 gramas de cinábrio tem 70 gramas de sulfeto de mercúrio II. Vamos calcular para uma tonelada de cinábrio quanto tem de sulfeto de mercúrio II.
Resumo teórico
Leitura percentual: 70% de sulfeto de mercúrio II no cinábrio significa que cada 100 gramas de cinábrio tem 70 gramas de sulfeto de mercúrio II. Vamos calcular para uma tonelada de cinábrio quanto tem de sulfeto de mercúrio II.
Resolução do exercício
100g ................... 70 g
1.000.000g .......... x g
x = 700.000 gramas de sulfeto de mercúrio II
Cálculo da massa de mercúrio.
Massa do sulfeto de mercúrio II = HgS = (1 .200) + (1 .32) = 232gramas de sulfeto de mercúrio II tem 200 gramas de mercúrio.
232g(HgS) .............. 200(Hg)
700.000 g (HgS) ...... x g (Hg)
x = 603.000g = 603 quilogramas
100g ................... 70 g
1.000.000g .......... x g
x = 700.000 gramas de sulfeto de mercúrio II
Cálculo da massa de mercúrio.
Massa do sulfeto de mercúrio II = HgS = (1 .200) + (1 .32) = 232gramas de sulfeto de mercúrio II tem 200 gramas de mercúrio.
232g(HgS) .............. 200(Hg)
700.000 g (HgS) ...... x g (Hg)
x = 603.000g = 603 quilogramas
08) A porcentagem, em massa, de etanol, em uma solução aquosa dessa substância, é igual a 46%. Calcular quantos mols tem de álcool e água por litro de solução.
Resumo teórico
Leitura ponderal: 46%, em massa , de etanol significa que 100gramas de solução aquosa tem 46gramas de etanol e a diferença é 54gramas de água.
Como o volume da solução aquosa é de 1litro ou 1000mililitros sua massa será igual a 1000gramas, considerando densidade igual a 1g/mL.
1000gramas é dez vezes maior que 100gramas, logo teremos 10 vezes mais massa de álcool e água, ou seja 460gramas de álcool e 540gramas de água.
==> Cálculo da quantidade em mols de etanol
A relação de cálculo é massa e mols de etanol.
A massa de um mol é calculada tendo a fórmula da substância, neste caso etanol.
A palavra ETANOL significa ET = 2 carbonos; AN = ligação simples entre carbonos e OL = grupo "OH" ligado no álcool em carbono saturado.
Fórmula molecular = CH3-CH2-OH => C2H6O
Resolução do exercício
Massa molar = (2 .12) + (6 .1) + (1 .16) = 46gramas por mol
1 mol .............. 46g
x mol ............ 460g
x = 10mols
==> Cálculo da quantidade em mols da água
A relação de cálculo é massa e mols de água
A massa de um mol é calculada tendo a fórmula da substância, neste caso água.
Fórmula molecular = H2O
Massa molar = (2 .1) + (1 .16) = 18gramas por mol
1 mol .............. 18g
x mol ............ 540g
09) O urânio é um elemento cujos átomos contêm 92 prótons, 92 elétrons e entre 135 e 148 nêutrons. O isótopo de urânio 235U é utilizado como combustível em usinas nucleares, onde, ao ser bombardeado por nêutrons, sofre fissão do seu núcleo e libera uma grande quantidade de energia igual a 2,35 .1010 kJ/mol.
O isótopo 235U ocorre naturalmente em minérios de urânio, com concentração de apenas 0,7%. Para ser utilizado na geração de energia nuclear, o minério é submetido a um processo de enriquecimento, visando aumentar a concentração do isótopo 235U para aproximadamente, 3% nas pastilhas. Em décadas anteriores, houve um movimento mundial para aumentar a geração de energia nuclear buscando substituir, parcialmente, a geração de energia elétrica a partir da queima do carvão, o que diminui a emissão atmosférica de CO2 (gás com massa molar igual a 44 g/mol).
Resumo teórico
A queima do carvão é representada pela equação química:
C(s) + O2(g) => CO2(g) delta H = -400 KJ/mol
Qual é a massa de CO2 , em toneladas, que deixa de ser liberada na atmosfera, para cada 100 g de pastilhas de urânio enriquecido utilizadas em substituição ao carvão como fonte de energia?
Resolução do exercício
Inicialmente precisamos saber qual a quantidade de energia será liberada por uma pastilha de 100 gramas de urânio enriquecido, pois vamos considerar que este vai substituir a liberação de gás carbônico na liberação da mesma quantidade de energia.
Cálculo da quantidade de urânio enriquecido por pastilha.
100 gramas ................ 100%
x gramas ................... 3%
x = 3 gramas
Cálculo da quantidade de energia liberada quando o de urânio enriquecido sofrer fissão.
Leitura molar: 2,35 .1010 kJ/mol significa que 1 mol de urânio-235 pode liberar até 2,35 .1010 kJ de energia na fissão nuclear.
1 mol de urânio enriquecido = 235 gramas
235 gramas ................ 2,35 .1010 kJ
3 gramas ................... x kJ
x = 0,03 .1010 kJ é a energia liberada na fissão do urânio enriquecido e agora precisamos calcular a massa de gás carbônico produzida quando da queima de carvão(C) para produzir a mesma quantidade de energia.
Leitura molar: delta H = -400 KJ/mol, significa que cada mol ou 44 gramas de gás carbônico produzido ocorre liberação de 400 kJ.
44gramas ................ 400kJ
x gramas ................ 0,03 .1010 kJ
x = 0,0033 .1010 gramas = 33 . 106 gramas = 33 toneladas
10) O fluoreto de sódio é um dos componentes dos cremes dentais, pois inibe a desmineralização dos dentes, tornando-os menos sensíveis às cáries. Um determinado dentista recomendou a um paciente que fizesse bochechamento diário com uma solução 0,1% (m/v) de fluoreto de sódio (NaF). A solução sugerido apresenta uma concentração, em mol/L, de, aproximadamente:
Resumo teórico
Leitura ponderal: 0,1% (m/v) significa que cada 100mililitros de solução tem 0,1gramas de fluoreto de sódio.
Como a pergunta é concentração em mols de soluto por litro de solução precisamos transformar massa, em gramas, para mol e mililitros para litros.
Massa molar no NaF = (1 . 23) + (1 . 19) = 42g/mol
Resolução do exercício
1mol ................ 42gramas
X mols ............. 0,1grama
X = 0,0024mol
Volume em litros: 100mililitros é igual a 0,1litro.
Concentração = 0,0024mol / 0,1L = 0,024mol / L
11) Os ossos possuem 65% de sua massa constituída de matéria mineral. Esta, por sua vez, contém 80% de fosfato de cálcio. Calcular a massa de cálcio, em quilogramas(kg), que se pode obter a partir de uma tonelada de ossos.
Resumo teórico e resolução do exercício
Cálculo da massa de matéria mineral.
65 kg ............... 100 kg
x kg ................. 1.000Kg
x= 650 kg
Cálculo da quantidade de fosfato de cálcio na matéria mineral
650kg ................ 100%
x kg .................. 80%
x = 520 kg
Cálculo da quantidade de íons cálcio presentes nessa quantidade de fosfato de cálcio.
Fórmula: Ca3(PO4)2
Massa molar do fosfato de cálcio: (3 .40) + (2 .31) + (8. 16) = 310g
Leitura mássica usando a fórmula: em 310 gramas de fosfato de cálcio temos 120 gramas de íons cálcio.
Cálculo da massa de íons cálcio em 650kg de fosfato de cálcio.
Fosfato ............. íons cálcio
310g ................. 120g
650.000g .......... x gramas
x = 252.000 gramas = 252 kg
Resumo teórico e resolução do exercício
Cálculo da massa de matéria mineral.
65 kg ............... 100 kg
x kg ................. 1.000Kg
x= 650 kg
Cálculo da quantidade de fosfato de cálcio na matéria mineral
650kg ................ 100%
x kg .................. 80%
x = 520 kg
Cálculo da quantidade de íons cálcio presentes nessa quantidade de fosfato de cálcio.
Fórmula: Ca3(PO4)2
Massa molar do fosfato de cálcio: (3 .40) + (2 .31) + (8. 16) = 310g
Leitura mássica usando a fórmula: em 310 gramas de fosfato de cálcio temos 120 gramas de íons cálcio.
Cálculo da massa de íons cálcio em 650kg de fosfato de cálcio.
Fosfato ............. íons cálcio
310g ................. 120g
650.000g .......... x gramas
x = 252.000 gramas = 252 kg
12) Que massa de ferro, em quilogramas, existe em 0,5 toneladas de magnetita contendo 90% de óxido salino de ferro (Fe3O4)?
Resumo teórico e resolução do exercício
Cálculo da massa pura de óxido de ferro na magnetita.
0,5 toneladas = 500 quilogramas
100kg ............ 90 kg
500kg ............. x g
x = 450 kg da parte pura do minério magnetita é de Fe3O4.
Consequentemente 10% ou 50kg constituem a impureza.
Massa molar do Fe3O4: (3 . 56) + (4. 16) = 232 gramas
Leitura mássica: em 232 gramas de Fe3O4 temos 168 gramas de ferro.
450 quilogramas = 450.000 gramas
Fe3O4 ............... Fe
232g .............. 168g
450.000g ........ x g
x = 326.000g = 326 kg
Cálculo da massa pura de óxido de ferro na magnetita.
0,5 toneladas = 500 quilogramas
100kg ............ 90 kg
500kg ............. x g
x = 450 kg da parte pura do minério magnetita é de Fe3O4.
Consequentemente 10% ou 50kg constituem a impureza.
Massa molar do Fe3O4: (3 . 56) + (4. 16) = 232 gramas
Leitura mássica: em 232 gramas de Fe3O4 temos 168 gramas de ferro.
450 quilogramas = 450.000 gramas
Fe3O4 ............... Fe
232g .............. 168g
450.000g ........ x g
x = 326.000g = 326 kg
13) Quantas gramas de íons cálcio existem em 500gramas de cloreto de cálcio di-hidratado, contendo 5% de impurezas.
Resumo teórico
Fórmula do cloreto de cálcio di-hidratado: CaCl2.2H2O
Massa molar[CaCl2.5H2O]:(1. 40) + (2. 35,5) + (2. 18) = 147 gramas
Leitura mássica: 201 gramas de cloreto de cálcio di-hidratado contém 40 gramas de íons cálcio.
Fórmula do cloreto de cálcio di-hidratado: CaCl2.2H2O
Massa molar[CaCl2.5H2O]:(1. 40) + (2. 35,5) + (2. 18) = 147 gramas
Leitura mássica: 201 gramas de cloreto de cálcio di-hidratado contém 40 gramas de íons cálcio.
Resolução do exercício
Cálculo da massa de cloreto de cálcio di-hidratado puro, que é 95% de 500 gramas.
500gramas ............... 100%
x gramas ................. 95%
x = 475gramas
Cálculo da massa de íons cálcio no cloreto de cálcio di-hidratado.
147gramas ............... 40gramas
475 gramas .............. x gramas
x = 129,5 gramas
Cálculo da massa de cloreto de cálcio di-hidratado puro, que é 95% de 500 gramas.
500gramas ............... 100%
x gramas ................. 95%
x = 475gramas
Cálculo da massa de íons cálcio no cloreto de cálcio di-hidratado.
147gramas ............... 40gramas
475 gramas .............. x gramas
x = 129,5 gramas
14) Determinar o número de mols de água de cristalização do sulfato de magnésio, sabendo-se que 3,63 gramas deste sal hidratado contêm 51,4% de água de cristalização.
Resumo teórico
Leitura percentual: 51,4% de água de cristalização significa que em cada 100 gramas do sal hidratado teremos 51,4 gramas de água.
Resumo teórico
Leitura percentual: 51,4% de água de cristalização significa que em cada 100 gramas do sal hidratado teremos 51,4 gramas de água.
Resolução do exercício
Cálculo da massa de água de cristalização.
51,4gramas .............. 100gramas
x gramas .................. 3,63gramas
x = 1,86gramas é a quantidade de água de cristalização, logo o sal sem a água tem massa de 1,77gramas (3,63 - 1,86).
Cálculo da massa do sal hidratado: MgSO4. xH2O = (24. 1) + (4. 16) + 18x = 120 + 18x
Precisamos calcular o valor do "x" e saberemos quantos mols tem de água de cristalização.
A proporção será entre as massas do sal com água(hidratado) e as massas do sal sem água(anidro):
3,63g .............. 120 + 18x
1,77g .............. 120
x = 7
Cálculo da massa de água de cristalização.
51,4gramas .............. 100gramas
x gramas .................. 3,63gramas
x = 1,86gramas é a quantidade de água de cristalização, logo o sal sem a água tem massa de 1,77gramas (3,63 - 1,86).
Cálculo da massa do sal hidratado: MgSO4. xH2O = (24. 1) + (4. 16) + 18x = 120 + 18x
Precisamos calcular o valor do "x" e saberemos quantos mols tem de água de cristalização.
A proporção será entre as massas do sal com água(hidratado) e as massas do sal sem água(anidro):
3,63g .............. 120 + 18x
1,77g .............. 120
x = 7
15) Um composto de massa molar igual a 152 gramas forma um hidrato contendo 45,3% de água de hidratação. Calcular quantos mols de água de cristalização tem o composto hidratado.
Resumo teórico
Precisamos calcular quantos mols(x) tem de água neste sal hidratado.
Leitura porcentual: 45,3% significa que em cada 100 gramas do sal hidratado tem 45,3 gramas de água.
Leitura da quantidade de água no sal hidratado: o sal hidratado terá massa igual a 152gramas mais a água que será 18x, onde o "x" será nosso objetivo de cálculo.
Resolução do exercício
100 g (sal) ..................... 45,3 g(água)
152 + 18x g(sal) ............. 18x g (água)
x = 7 mols
16) Para a prevenção de cáries, em substituição à aplicação local de flúor nos dentes, recomenda-se o consumo de “água fluoretada”.
Sabendo-se que a porcentagem, em massa, de fluoreto de sódio na água é de 2 .10–4 %, um indivíduo que bebe 1 litro dessa água, diariamente, terá ingerido uma massa, em gramas, desse sal igual a:
Sabendo-se que a porcentagem, em massa, de fluoreto de sódio na água é de 2 .10–4 %, um indivíduo que bebe 1 litro dessa água, diariamente, terá ingerido uma massa, em gramas, desse sal igual a:
Dado: densidade da água fluoretada 1,0 g/mL
Resumo teórico
Leitura ponderal: 2 .10–4 % significa que 0,0002 gramas de fluoreto de sódio estão dissolvidos em 100 gramas de água fluoretada.
Um litro ou 1000 mililitros de água fluoretada tem massa igual a 1000 gramas, ou seja dez vezes maior que 100 gramas, logo a quantidade de fluoreto de sódio será dez vezes maior, ou seja 0,002 gramas ou 2 .10–3 gramas.
Resolução do exercício
Montando a regra de três.
0,0002g ........................ 100 g
x gramas ...................... 1000g
x = 0,002 gramas
Montando a regra de três.
0,0002g ........................ 100 g
x gramas ...................... 1000g
x = 0,002 gramas
17) Existe um percentual de 30% de álcool numa mistura de 6000 litros de álcool e gasolina, para transformar esse percentual para 24%, quanto de gasolina deve-se adicionar na mistura?
Resumo teórico e resolução do exercício
Precisamos saber quanto de álcool temos que é a quantidade que não vai variar.
mistura ............... %
6000 litros .......... 100%
x litros ................. 30%
x = 1800 litros de álcool
Após adicionar mais gasolina os 1800 litros de álcool corresponderão a 24% do volume total da solução e não mais aos 30%, logo a quantidade de gasolina será 100 – 24 = 76% do volume total da solução, montando a regra de três teremos:
álcool => 1800 litros ........... 24%
gasolina => x litros ............. 76%
x = 5700 litros de gasolina.
18) A hemoglobina é uma metaloproteína que contém 0,35% de Fe em massa. Ela está presente nos glóbulos vermelhos e permite o transporte de oxigênio pelo sistema circulatório. Sabendo-se que a molécula de hemoglobina contém 4 átomos de Fe, sua massa molar é de aproximadamente:
Resumo teórico
Leitura percentual: 0,35% significa que cada 100 gramas de hemoglobina tem 0,35 gramas de íons ferro.
Leitura da massa molar: massa molar significa a massa de um mol da substância, ou seja, a massa correspondente a 6,02 . 1023 partículas, neste caso moléculas de hemoglobina.
Legenda: Ferro => Fe Hemoglobina => Hb
Leitura percentual: 0,35% significa que cada 100 gramas de hemoglobina tem 0,35 gramas de íons ferro.
Leitura da massa molar: massa molar significa a massa de um mol da substância, ou seja, a massa correspondente a 6,02 . 1023 partículas, neste caso moléculas de hemoglobina.
Legenda: Ferro => Fe Hemoglobina => Hb
Resolução do exercício
Calcular a massa de 4 átomos de ferro.
6,02 . 1023 átomos Fe ................... 56 gramas
4 átomos .......................................... x gramas
x = 37,2 . 10-23 gramas
Esta massa corresponde a 0,35% da massa total de uma molécula de hemoglobina.
37,2 . 10-23 gramas ...................... 0,35%
x gramas ......................................... 100%
x = 10.630 . 10-23 gramas é a massa de uma molécula de hemoglobina.
Cálculo da massa molar, ou seja, da massa de um mol de hemoglobina.
10.630 . 10-23 gramas ....................... 1 molécula de Hb
x gramas ........................................... 6,02 . 1023 gramas moléculas de Hb
x = 63.993 g
Calcular a massa de 4 átomos de ferro.
6,02 . 1023 átomos Fe ................... 56 gramas
4 átomos .......................................... x gramas
x = 37,2 . 10-23 gramas
Esta massa corresponde a 0,35% da massa total de uma molécula de hemoglobina.
37,2 . 10-23 gramas ...................... 0,35%
x gramas ......................................... 100%
x = 10.630 . 10-23 gramas é a massa de uma molécula de hemoglobina.
Cálculo da massa molar, ou seja, da massa de um mol de hemoglobina.
10.630 . 10-23 gramas ....................... 1 molécula de Hb
x gramas ........................................... 6,02 . 1023 gramas moléculas de Hb
x = 63.993 g
19) Em um experimento, 10 gramas de uma liga de latão, constituída por cobre e zinco, foram tratados com uma solução aquosa de ácido clorídrico.
O cobre não reagiu, mas o zinco reagiu de acordo com
Da massa total, 10 gramas, após a reação reagiram 2,2 gramas de zinco e sobraram 7,8 gramas de cobre no filtro.
O cobre não reagiu, mas o zinco reagiu de acordo com
Zn (s) + 2H1+(aq) => Zn2+(aq) + H2(g)
Após o ataque por ácido clorídrico, a massa de sólido remanescente, filtrado e seco, era igual a 7,8 gramas.
Com base nesses dados, é correto afirmar que a porcentagem ponderal de zinco na liga era aproximadamente igual a:
Com base nesses dados, é correto afirmar que a porcentagem ponderal de zinco na liga era aproximadamente igual a:
Resumo teórico
20) A embalagem de um sal de cozinha comercial com reduzido teor de sódio, o chamado "sal light", traz a informação: "cada 100g contém 20g de ions sódio ... ". Isso significa que a porcentagem, em massa, de cloreto de sódio nesse sal é aproximadamente igual a:
Resumo teórico e resolução do exercício
Cálculo da massa correspondente de cloreto de sódio que possui 20gramas de íons sódio.
Massa molar (NaCl) = (1 . 23) + (1 . 35) = 58gramas por mol.
Cada 58gramas de cloreto de sódio é formada por 23gramas de íons sódio.
58g ........... 23g
x g ............ 20g
21) O ferro é um elemento essencial na alimentação humana para formação de hemoglobina. Apenas 10% do ferro do feijão é absorvido pelo organismo humano. Supondo que em 100 gramas de feijão encontremos 0,2% de ferro e que cada átomo de ferro formará uma molécula de hemoglobina o número de moléculas de hemoglobina formada será:
Resumo teórico
O objetivo é calcular número de átomos de ferro cujo valor será igual ao número de moléculas de hemoglobina.
Leitura percentual 1 : 100 g de feijão encontramos 0,2% de ferro, significa que em cada 100 gramas de feijão teremos 0,2 gramas de ferro.
Leitura percentual 2: 10% do ferro do feijão é absorvido pelo organismo humano, significa que cada 100 gramas de ferro apenas 10 gramas será absorvido pelo nosso organismo, ou seja 10% da massa de 0,2 gramas de ferro será absorvida formando moléculas de hemoglobina.
Leitura percentual 1 : 100 g de feijão encontramos 0,2% de ferro, significa que em cada 100 gramas de feijão teremos 0,2 gramas de ferro.
Leitura percentual 2: 10% do ferro do feijão é absorvido pelo organismo humano, significa que cada 100 gramas de ferro apenas 10 gramas será absorvido pelo nosso organismo, ou seja 10% da massa de 0,2 gramas de ferro será absorvida formando moléculas de hemoglobina.
Resolução do exercício
0,2 gramas ................ 100%
x gramas .................... 10%
x = 0,02 gramas serão absorvidas pelo nosso organismo formando moléculas de hemoglobina.
Precisamos transformar esta massa em número de átomos.
56 gramas de Fe ................ 6,02 .1023 átomos
0,02 gramas de Fe ............ x átomos
x = 2,15 .1020 átomos de ferro formará a mesma quantidade de moléculas de hemoglobina, pois a relação é de 1:1.
0,2 gramas ................ 100%
x gramas .................... 10%
x = 0,02 gramas serão absorvidas pelo nosso organismo formando moléculas de hemoglobina.
Precisamos transformar esta massa em número de átomos.
56 gramas de Fe ................ 6,02 .1023 átomos
0,02 gramas de Fe ............ x átomos
x = 2,15 .1020 átomos de ferro formará a mesma quantidade de moléculas de hemoglobina, pois a relação é de 1:1.
22) Uma barra de chocolate contém, aproximadamente, 60% de carboidratos, 7% de proteínas e 27% de lipídios. Quantas horas uma pessoa deve caminhar para consumir a energia fornecida pelo consumo de uma barra de chocolate de 100g ?
Dados de energia:
Resumo teórico
=> combustão das proteínas = 22kJ/g , significa que cada grama de proteína queimada libera 22kJ de energia.
=> combustão dos carboidratos = 17kJ/g , significa que cada grama de carboidrato queimado libera 17kJ de energia.
=> combustão dos lípidios = 38kJ/g , significa que cada grama de lipídio queimado libera 38kJ de energia.
=> consumida em uma caminhada =1100kJ/h , significa que cada hora de caminhada teremos um consumo de energia igual a 1100kJ.
Leitura percentual: 60% de carboidratos significa que em 100g de chocolate teremos 60g de carboidratos.
7% de proteínas significa que em 100g de chocolate teremos 7g de proteínas.
27% de lípidios significa que em 100g de chocolate teremos 27g de lipídios.
Cálculo da energia adquirida após consumo de 100g de chocolate.
Esta energia é a soma das energia produzidas pelas proteínas, lipídios e carboidratos consumidos.
Resolução do exercício
Conforme dados cada grama de proteína queimada libera 22kJ.
1g ............ 22kJ
7g ............ x
x = 154kJ
Conforme dados cada grama de lípidio queimado libera 38kJ.
1g ........... 38kJ
27g ......... x
x = 1026kJ
Conforme dados cada grama de carboidrato queimado libera 17kJ.
1g ............ 17kJ
60g .......... x
x = 1020kJ
Energia total consumida
1020 + 1026 + 154 = 2200kJ
Cálculo da quantidade em horas.
1100 kJ ............ 1 hora
2200 kJ ............ x
x = 2 horas
23) O efeito estufa é uma das mais graves agressões humanas à natureza. Esse efeito é causado por quantidades determinadas de gases tais como o dióxido de carbono, os clorofluorcarbonos, o metano, o dióxido de nitrogênio, dentre outros. As principais fontes de contaminação da natureza pelo dióxido de carbono são a queima de combustíveis fósseis, a queima de florestas e também a fumaça dos cigarros.
Somente no ano de 2020, estima-se que foram consumidos, no país, cerca de 164 bilhões de cigarros.
Considere que a massa de um cigarro seja de 0,85gramas e que 40% da massa do cigarro seja constituída pelo elemento carbono.
Calcule quantas toneladas de dióxido de carbono, em valores arredondados, os fumantes lançaram na atmosfera em 2020.
Resumo teórico
Leitura porcentual: cada 100partes de cigarro tem 40partes de carbono ou cada 100gramas de cigarro tem 40gramas de carbono.
Resolução do exercício
Cálculo da quantidade de carbono por cigarro.
100g ......... 40g
0,85g ........ x
x = 0,34gramas
Como a pergunta é referente ao dióxido de carbono e não diretamente do carbono, precisamos transformar a massa de carbono (C) para massa de dióxido de carbono (CO2).
Massa molar do CO2 = (1 . 12) + (2 . 16) = 44gramas de dióxido de carbono é formada por 12gramas de carbono.
44g ......... 12g
x g .......... 0,34g
x = 1,25gramas é o que pode ser produzido de dióxido de carbono por cigarro queimado.
Cálculo da quantidade de dióxido de carbono em 164 bilhões de cigarros.
164.000.000.000 cigarros = 164 .109 cigarros
1cigarro ............................ 1,25g
164 .109 cigarros ............ x g
24) No processo de produção do ferro a partir da hematita, minério rico em óxido de ferro, a sílica (dióxido de silício) é removida por reação com o calcário (carbonato de cálcio).
Resumo teórico
Com a aplicação dos fundamentos dos cálculos estequiométricos, é possível afirmar que são necessários 100 gramas de calcário para reagir com 60 gramas de sílica.
O minério de ferro apresenta em média 1% de sílica.
A quantidade de calcário utilizada para a remoção de toda sílica em 200 toneladas desse minério, é igual a ?
Leitura percentual: 1% de sílica significa que em 100 partes de minério tem uma parte de sílica ou 100 toneladas de minério tem uma tonelada de sílica, logo 200 toneladas de minério terá 2 toneladas de sílica misturada, como impureza.
Resolução do exercício
Cálculo da quantidade de calcário para remover a sílica.
100g .............. 60g
x ton .............. 2ton
x = 3,33toneladas
25) Em 2003 pacientes que foram submetidos a exame de raios-X no diagnóstico de úlceras do aparelho digestivo, usando uma suspensão aquosa de sulfato de bário como contraste, morreram em consequência de envenenamento por íons bário. As investigações indicaram que o lote encontrava-se contaminado por carbonato de bário (14% contra um limite máximo de 0,001%).
Qual a massa de sulfato de bário, em miligramas, contendo 14% de BaCO3 como impureza, seria suficiente para matar um paciente, sabendo que a dose letal de cátions bário (Ba2+) é 35miligramas.
Resumo teórico
O carbonato de bário é formado por cátions bário e ânions carbonato, logo tendo a massa de cátions bário poderemos achar a massa de carbonato de bário que corresponder a 14% da mistura.
Resolução do exercício
Massa molar (BaCO3) = (1 . 137) + (1 . 12) + (3 . 16) = 197gramas por mol
197g de BaCO3 é formado por 137 g de cátions bário.
Lembre que o prefixo "mili" significa dividir por 1000
197 g ............. 137 g
x g ................ 0,035g
x = 0,050g de BaCO3
Leitura percentual: cada 100g da mistura tem 14gramas de carbonato de bário.
100g ................. 14g
x g .................... 0,050g
26) Calcular a composição centesimal (%) da água.
Resumo teórico
Leitura porcentual: 18 gramas de água corresponde a 100% de massa.
Massa molar: (2 . 1) + (1 . 16) = 18 gramas de água é formada por 2 gramas de hidrogênio e 16 gramas de oxigênio.
Resolução do exercício
Porcentagem de hidrogênio
18 g ............. 100%
2 g ............... x
x = 11,11 %
Porcentagem de oxigênio
18 g ............. 100%
16 g .............. x
x = 88,89 %
x = 88,89 %
27) Que massa de óxido salino de ferro, em toneladas, existe em 0,5 toneladas de magnetita contendo 90% deste óxido.
Resumo teórico
Leitura percentual: 90% de óxido salino de ferro significa que em cada 100 toneladas de magnetita teremos 90 toneladas de óxido de ferro salino.
Resolução do exercício
100 toneladas .......... 90 toneladas
0,5 toneladas .......... x
x = 0,45 toneladas
28) Um soro fisiológico é uma solução aquosa que contém 0,9%, em massa de cloreto de sódio.
Para preparar 200 gramas dessa solução, a quantidade necessária de cloreto de sódio é de:
Resumo teórico e resolução do exercício
29) Em um experimento, 10g de uma liga de latão, constituída por cobre e zinco, foram tratados com uma solução de HCl. O cobre não reagiu, mas o zinco reagiu.
Após o ataque do HCl, a massa do sólido remanescente, filtrado e seco, era igual a 7,8g.
Com base nesses dados, é correto afirmar que a porcentagem ponderal de zinco na liga era de aproximadamente igual a ?
Resumo teórico
Tratados significa misturados, adicionados a uma solução ácida.
Após o ataque significa após a reação com ......
Sólido remanescente significa que não reagiu.
Porcentagem ponderal significa porcentagem em massa.
Porcentagem em massa: é a relação entre a massa de um dos componentes com a massa total.
Resolução do exercício
10gramas de latão é constituído por 7,8gramas de cobre que não reagiu e 2,2gramas de zinco que reagiu, logo:
10g ........... 100%
2,2g .......... x%
30) Atualmente, sistemas de purificação de emissões poluidoras estão sendo exigidos por lei em um número cada vez maior de países. O controle das emissões de dióxido de enxofre gasoso, provenientes da queima de carvão que contém enxofre, pode ser feito pela reação desse gás com uma suspensão de hidróxido de cálcio em água, sendo formado um produto não poluidor do ar. A queima do enxofre e a reação do dióxido de enxofre com o hidróxido de cálcio, bem como as massas de algumas das substâncias envolvidas nessas reações, podem ser assim representadas:
S(32g) + O2(32g) => SO2(64g)
SO2(64g) + Ca(OH)2(74g) => produto não poluidor
Dessa forma, para absorver todo o dióxido de enxofre produzido pela queima de uma tonelada de carvão (contendo 1% de enxofre), é suficiente a utilização de uma massa de hidróxido de cálcio, em quilogramas, de aproximadamente:
Leitura percentual: 1% de enxofre significa que em 100kg de carvão temos 1quilograma de enxofre.
1tonelada = 1000quilogramas, logo teremos 10quilogramas de enxofre, correspondente a 1%.
Observe na sequência de reações que: 32gramas de enxofre reagem com oxigênio formando 64gramas de dióxido de enxofre que por sua vez reage com 74 gramas de hidróxido de cálcio.
Resolução do exercício
Como o interesse esta no enxofre, pois este vai reagir com o oxigênio formando o dióxido de enxofre, e no hidróxido de cálcio usaremos suas massa para o cálculo.
32g ............... 74g
10kg ............. x
x = 23kg = 23.000 gramas

31) A substituição de aço por alumínio permite a fabricação de veículos mais leves, com consequente redução do consumo de combustíveis e aumento da resistência à corrosão. Modelos mais recentes já empregam em torno de 90 quilogramas de alumínio por unidade produzida. O alumínio é geralmente extraído da bauxita, minério que contém Al2O3. Quantos veículos podem ser produzidos com o alumínio obtido a partir de 2040quilogramas de bauxita, com 50% de Al2O3
Resumo teórico e resolução do exercício
Precisamos calcular a quantidade de óxido de alumínio que o minério bauxita pode produzir e qual a quantidade de alumínio que o óxido de alumínio pode formar.
Do texto 50% de 2040kg de bauxita é óxido de alumínio.
2040kg ............ 100%
x kg ................ 50%
x = 1020quilogramas
Massa molar do óxido de alumínio.
Al2O3 = (2 . 27) + (3 . 16) = 102gramas
Leitura de massa: 102gramas de óxido de alumínio é formado por 54gramas de alumínio.
102g ................. 54g
1020kg ............. x
x = 540kg
Cada veículo consome 90quilogramas de alumínio, precisamos calcular para 540quilogramas.
1 veículo ......... 90kg
x veículos ....... 540kg
x = 6 veículos
Precisamos calcular a quantidade de óxido de alumínio que o minério bauxita pode produzir e qual a quantidade de alumínio que o óxido de alumínio pode formar.
Do texto 50% de 2040kg de bauxita é óxido de alumínio.
2040kg ............ 100%
x kg ................ 50%
x = 1020quilogramas
Massa molar do óxido de alumínio.
Al2O3 = (2 . 27) + (3 . 16) = 102gramas
Leitura de massa: 102gramas de óxido de alumínio é formado por 54gramas de alumínio.
102g ................. 54g
1020kg ............. x
x = 540kg
Cada veículo consome 90quilogramas de alumínio, precisamos calcular para 540quilogramas.
1 veículo ......... 90kg
x veículos ....... 540kg
x = 6 veículos
Resolução por análise dimensional
Na análise dimensional as igualdades e proporções viram frações que se multiplicam entre si ou com dados solicitados no exercício e no final das multiplicações a unidade solicitada deverá aparecer sozinha.
32) Quantas gramas de fenolftaleína e quantos mols de álcool existem em 200 gramas de solução alcoólica de fenolftaleína contendo 8%, em massa, de soluto.
Resumo teórico
Leitura percentual: 8%, em massa de soluto, significa que 100 gramas de solução alcoólica tem 8 gramas de fenolftaleína, logo em 200 gramas terá o dobro, ou seja 16 gramas.
Para calcular o número de mols de álcool etílico ou etanol precisamos da massa de álcool contida na solução e da massa de um mol também do álcool.
Massa da solução = 200gramas
Massa de fenolftaleína = 16gramas
Massa de álcool = 200 - 16 = 184gramas
Fórmula do álcool etílico = C2H6O
Resolução do exercício
Massa molar de C2H6O = (2 . 12) + (6 . 1) + (1 . 16) = 46gramas
1mol de álcool ................. 46gramas
x mols de álcool ............. 184gramas
x = 4mols
Resolução por análise dimensional
Na análise dimensional as igualdades e proporções viram frações que se multiplicam entre si ou com dados solicitados no exercício e no final das multiplicações a unidade solicitada deverá aparecer sozinha.
Massa de fenolftaleína = 16gramas
Massa de álcool = 200 - 16 = 184gramas
Massa da solução = 200gramas
Massa de fenolftaleína = 16gramas
Massa de álcool = 200 - 16 = 184gramas
33) Trataram-se 3,33g de uma mistura de CaCl2 e NaCl com carbonato, a fim de precipitar todo o cálcio sob forma de CaCO3, que foi então aquecido e transformado em CaO puro. A massa final do CaO obtida foi 0,56g. A porcentagem em massa de CaCl2 na mistura primitiva era de aproximadamente:
Resumo teórico
Leitura percentual: 3,33gramas da mistura corresponde a 100% de sua massa, logo precisamos saber qual é a massa de cloreto de cálcio (CaCl2) presente na mistura para calcular a que porcentagem corresponderá esta massa.
Sequência de transformações conforme o texto
1CaCl2 => 1CaCO3 => 1CaO
Leitura molar: 1mol de cloreto de cálcio se transforma em 1 mol de carbonato de cálcio e este se transforma em um mol de óxido de cálcio.
Resolução do exercício
Massas molares => CaCl2 = (1 . 40) + (2 . 35,5) = 111gramas por mol
CaCO3 = (1 . 40) + (1 . 12) + (3 . 16) = 100gramas por mol
CaO = (1 . 40) + (1 . 16) = 56gramas por mol
Do texto: “A massa final do CaO obtida foi 0,56g”, observe que é 100 vezes menor que 56g, logo a massa inicial de cloreto de cálcio também será 100 vezes menor, para seguir a proporção de transformação, ou seja 1,11gramas, que será a massa encontrada na mistura.
Cálculo da porcentagem de cloreto de cálcio na mistura.
3,33g ............... 100%
1,11g ............... x%
x = 33,3%
Resolução por análise dimensional
Na análise dimensional as igualdades e proporções viram frações que se multiplicam entre si ou com dados solicitados no exercício e no final das multiplicações a unidade solicitada deverá aparecer sozinha.
Unidade solicitada: porcentagem, será calculada dividindo a massa de cloreto de cálcio pela massa total da mistura e o resultado multiplicado por 100.
34) O álcool hidratado usado como combustível tem densidade aproximada de 1g/mL e apresenta em média 3,7% em massa, de água dissolvida no álcool puro.
O número de mols de etanol em um litro desta mistura é de aproximadamente.
Resumo teórico
Leitura percentual: 3,7% em massa, de água significa que em 100gramas de álcool hidratado temos 3,7gramas de água e 96,3gramas de álcool.
Fórmula do etanol: C2H6O
Resolução do exercício
Massa molar: (2 . 12) + (6 . 1) + (1 . 16) = 46 gramas por mol.
O número de mols de etanol em um litro ou 1000 mililitros ou 1000gramas, pois a densidade é considerada igual a 1, desta mistura será.
100gramas do álcool hidratado tem 96,3gramas de álcool, logo 1000gramas terá dez vezes mais, ou seja 963gramas de álcool.
1mol ................. 46g
x mol ................ 963g
x = 21 mols
Na análise dimensional as igualdades e proporções viram frações que se multiplicam entre si ou com dados solicitados no exercício e no final das multiplicações a unidade solicitada deverá aparecer sozinha.
35) A fórmula do colesterol é C27H46O. Nela, a porcentagem de oxigênio é de aproximadamente:
Resumo teórico
Leitura molar: um mol de colesterol é formado por 1 mol do elemento oxigênio, para calcular a porcentagem precisamos das massas correspondentes.
Resolução do exercício
Massa Molar: (27 . 12) + (46 . 1) + 16 = 386 gramas por mol.
Leitura percentual: 386g corresponde a 100% da massa do colesterol.
386g .............. 100%
16g ................ x %
36) A expressão "ouro 18 quilates" designa uma liga muito usada em joalheria, na qual existem 18 partes de ouro, em massa, para um total de 24 partes, em massa, sendo o restante constituído geralmente por cobre e/ou prata. Pode-se afirmar que, no "ouro 18 quilates", a porcentagem, em massa, de ouro é:
resumo teórico
Leitura percentual: 24 partes da liga corresponde a 100%, precisamos saber qual a porcentagem de 18 partes.
Resolução do exercício
24partes ................ 100%
18 partes ............... x
x = 75%
Resolução alternativa por análise dimensional
37) Um óxido de vanádio apresenta 56% de vanádio. A fórmula deste óxido é:
Resumo teórico
Leitura percentual: 100g do Óxido de Vanádio é formado por 56g de Vanádio e 44g de Oxigênio.
Leitura molar: um mol de Óxido de Vanádio é formado por "x' mols do elemento Vanádio e "y" mols do elemento Oxigênio.
Resolução do exercício
Cálculo do número de mols do elemento Vanádio, usando a tabela periódica para saber a massa, em gramas, de um mol.
1mol .................... 51g
x mols ................. 56g
x = 1,1 mol
Cálculo do número de mols do elemento Oxigênio, usando a tabela periódica para saber a massa, em gramas, de um mol.
1mol .................... 16g
y mols ................. 44g
y = 2,75 mol
Transformando em número inteiros proporcionais.
Artifício matemático: a regra manda dividir os dois número pelo menor e se precisar multiplicar até chegar aos menores número inteiros.
Para o Vanádio: dividindo 1,1 por 1,1 teremos resultado igual a 1.
Para o Oxigênio: dividindo 2,75 por 1,1 teremos resultado igual a 2,5.
Para transformar em números inteiros vamos multiplicar os dois números por 2 e teremos 2 mols de Vanádio para 5 mols de Oxigênio.
Fórmula: V2O5
Resolução alternativa por análise dimensional
38) O nitrato de amônio é utilizado em adubos como fonte de nitrogênio.
A porcentagem, em massa, de nitrogênio no NH4NO3 é:
Resumo teórico
Massa molar: (2 . 14) + (4 . 1) + (3 . 16) = 80 gramas por mol
Leitura molar: cada mol de nitrato de amônio tem massa igual a 80 gramas sendo formado por 28 gramas de nitrogênio.
80g ...................... 100%
28g ...................... x %
x = 35%
Resolução alternativa por análise dimensional
Na análise dimensional as igualdades e proporções viram frações que se multiplicam entre si ou com dados solicitados no exercício e no final das multiplicações a unidade solicitada deverá aparecer sozinha.
Unidade solicitada: porcentagem (%) = massa de nitrogênio dividida pela massa do nitrato de amônio.

Unidade solicitada: porcentagem (%) = massa de nitrogênio dividida pela massa do nitrato de amônio.

39) Um adoçante dietético é uma mistura de
96,5% ................ Lactose
3,8% ................. Aspartame
0,6% ................. Dióxido de Silício
Um envelope com 1g de adoçante dietético tem na mistura quantos gramas de edulcorante artificial aspartame?
Resumo teórico e resolução do exercício
Leitura percentual: 3,8% de aspartame significa que em 100 gramas do adoçante tem 3,8gramas de aspartame, logo em uma grama terá cem vezes menos, ou seja 0,038gramas.
Resolução alternativa por análise dimensional
Na análise dimensional as igualdades e proporções viram frações que se multiplicam entre si ou com dados solicitados no exercício e no final das multiplicações a unidade solicitada deverá aparecer sozinha.
Unidade solicitada: gramas do edulcorante artificial, aspartame, no adoçante.
Resolução alternativa por análise dimensional
Na análise dimensional as igualdades e proporções viram frações que se multiplicam entre si ou com dados solicitados no exercício e no final das multiplicações a unidade solicitada deverá aparecer sozinha.
Unidade solicitada: gramas do edulcorante artificial, aspartame, no adoçante.
40) Que quantidade de uma solução de ácido sulfúrico 58% é necessária para se ter 150 gramas de ácido sulfúrico puro.
Resumo teórico
Leitura percentual: 58% significa que em 100gramas da solução teremos 58gramas de ácido sulfúrico.
Resolução do exercício
A relação é entre a massa da solução e a massa de ácido sulfúrico(soluto).
100g .............. 58g
x g ................ 150g
x = 258,6g de solução
41) A reação do monóxido de dinitrogênio com o gás oxigênio produz 2 mols de monóxido de mononitrogênio processando-se em um sistema sob pressão de 1,0 bar na temperatura de 25oC.
Partindo-se de 3,0 litros de uma mistura estequiométrica de monóxido de nitrogênio e gás oxigênio, o volume do sistema, quando 50% do monóxido de dinitrogênio tiver reagido, será de?
Resumo teórico e resolução do exercício
Reação: 1N2O(g) + 1/2O2(g) => 2NO(g)
3 litros é o total do volume ocupado pelos gases reagentes no início.
Como a proporção estequiométrica é: 1 : 1/2 : 2 o volume ocupado pelos gases seguirá a mesma proporção, ou seja no início teremos um valor correspondente de N2O e a metade de O2.
No início teremos o máximo de reagentes e zero de produto, pois nada ocorreu ainda.
Quantidade de reagentes no início: x mols de N2O e x/2 mols de O2 sendo a soma igual a 3 litros.
x + x / 2 = 3
x = 2 mols de N2O e a metade, 1 mol de O2
50% de N2O reagirá, ou seja 1mol que reagirá com 1/2mol de O2 formando 2mols de NO.
O volume total ocupado pelos gases no sistema será:
42) Qual é a porcentagem de trióxido de enxofre em um oleum (considerado como uma solução de trióxido de enxofre em ácido sulfúrico) rotulado “ácido sulfúrico a 109%”.
Resumo teórico e resolução do exercício
Esta designação refere-se ao peso total de ácido sulfúrico puro, 109gramas (100gramas de ácido sulfúrico existente no oleum mais 9 gramas de ácido sulfúrico que se formou pela reação da água com o trióxido de enxofre misturado no oleum).
Inicialmente 9 gramas de água combina-se com todo o trióxido de enxofre livre em 100gramas de oleum para fornecer um total de 109gramas de ácido sulfúrico.
A equação: H2O + SO3 => H2SO4
indica que um mol de água (18 gramas) combina-se com um mol de trióxido de enxofre (80 gramas). Portanto 9 gramas de água combina-se com 40 gramas de trióxido de enxofre.
Então 100 gramas de oleum contêm 40 gramas de trióxido de enxofre e a percentagem livre no oleum é 40%
Método alternativo por Análise Dimensional
Em geral qualquer fator de conversão é igual a 1, podendo ser
utilizado como multiplicador ou divisor de qualquer grandeza física. A escolha da multiplicação ou divisão depende do problema em questão.
Se no final das multiplicações e divisões não der a unidade desejada é por que houve alguma inversão durante o cálculo.
43) Uma fita de cobre eletroliticamente pura, pesando 3,178 gramas, foi fortemente aquecida em presença de oxigênio até ser completamente convertida em 3,978gramas de óxido preto. Qual a composição percentual deste óxido.
Resolução do exercício
Peso total do óxido preto = 3,978g
Massa de cobre no óxido = 3,178g
Massa de oxigênio no óxido = 0,800g
Percentagem de cobre no óxido
3,978g ............ 100%
3,178g ............ x
x = 79,9%
Percentagem de oxigênio no óxido
3,978g ............ 100%
0,800g ............ x
x = 20,1%
Verificação: 79,9% + 20,1% = 100%
44) Uma amostra impura de sulfeto de zinco contém 42,34% de zinco. Determine a percentagem de sulfeto de zinco puro nessa amostra.
Resumo teórico
A fórmula do sulfeto de zinco (ZnS) mostra que em um mol deste composto tem 1mol de zinco(Zn) ou 97,44gramas de ZnS é formado por 65,38gramas de zinco.
Resolução do exercício
Calculando a percentagem de zinco no sulfeto de zinco puro.
97,44g .......... 100%
65,38g .......... x
x = 67,1%
Se a amostra fosse 100% pura de ZnS, conteria 67,1% de zinco. Porém, como contém apenas 42,34% de zinco, ela será:
67,1% ........ 100%
42,34% ...... x
x = 63,1% de pureza em ZnS
45) Uma moeda de prata de 5,82 gramas foi dissolvida em ácido nítrico. Ao se adicionar cloreto de sódio a solução, toda a prata precipitou como AgCl.
Este precipitado pesou 7,2gramas.
Determine a porcentagem de prata na moeda.
Resumo teórico
Precisamos saber qual a massa de prata gerou o precipitado de AgCl.
1 mol de AgCl é formado por 1mol de prata ou 143,3gramas de AgCl é formado por 107,9gramas de prata, logo 7,20gramas de AgCl conterá ?
Resolução do exercício
143,3g .............. 107,9g
7,2g .................. x
x = 5,42g de prata
Cálculo da percentagem de prata nos 5,82gramas que é a massa da moeda.
5,82g ............... 100%
5,42g ............... x
x = 93,1%
Considerando que o destino do chumbo presente no vidro poderia ser o meio ambiente aqui no Brasil, qual seria, em mols, a quantidade de chumbo a ser recuperada para que isso não ocorresse?
Resolução do exercício
Cálculo da massa de chumbo na carga apreendida.
350t ............. 100%
x t ................ 11,5%
x= 40,3 toneladas = 40,3 x 106 gramas
Cálculo da quantidade, em mols, de chumbo.
1 mol ............ 207 gramas
x mol ............ 40,3 x 106 gramas
x = = 0,194 x 106 mol = 1,94 x 105mol
Cálculo da massa de chumbo na carga apreendida.
350t ............. 100%
x t ................ 11,5%
x= 40,3 toneladas = 40,3 x 106 gramas
Cálculo da quantidade, em mols, de chumbo.
1 mol ............ 207 gramas
x mol ............ 40,3 x 106 gramas
x = = 0,194 x 106 mol = 1,94 x 105mol
47) Quantas gramas de cobre existem em 300 gramas de sulfato de cobre II penta-hidratado, contendo 5% de impurezas?
Ácido concentrado é uma mistura de ácido puro com pouca água.
Leitura percentual: 69,8% significa que 100gramas do ácido concentrado tem 69,8gramas do ácido puro.
Leitura da densidade: cada centímetro cúbico ocupado pelo ácido concentrado tem massa igual a 1,42gramas, que representa a soma da massa de ácido puro mais a massa de água que esta misturada.
Precisamos calcular a massa de ácido puro(map) em um centímetro cúbico que apresenta massa de ácido concentrado(mac) igual a 1,42gramas.
mac ............. map
100g .......... 69,8g
x = 0,991gramas de ácido puro
Método alternativo por Análise Dimensional
1 cm3 ............... 1,285g
x = 1285gramas
Se 38%, em massa, do ácido são de ácido sulfúrico puro, o número de gramas de ácido sulfúrico puro em 1 litro de ácido para bateria é:
1285g ............. 100%
x = 488 gramas
Método alternativo por Análise Dimensional
Em geral qualquer fator de conversão é igual a 1, podendo ser utilizado como multiplicador ou divisor de qualquer grandeza física. A escolha da multiplicação ou divisão depende do problema em questão.
Resumo teórico
Leitura percentual: 5% de impureza significa que a pureza é de 95%, ou seja a amostra tem 95 gramas do sal(sulfato de cobre II penta-hidratado) em 100 gramas de amostra.
Leitura percentual: 5% de impureza significa que a pureza é de 95%, ou seja a amostra tem 95 gramas do sal(sulfato de cobre II penta-hidratado) em 100 gramas de amostra.
Resolução do exercício
Cálculo da massa de sal na amostra.
300g (amostra) ........... 100%
g (sal) ........................ 95%
x = 285gramas
Cálculo da massa molar do sal.
CuSO4. 5H2O = (63,5 .1) + (32 .1) + (16 .4) + (5 . 18) = 249,5gramas
Cálculo da massa de cobre, sabendo que 249,5 gramas do sal tem 63,5 gramas de cobre.
Sal ................. Cobre
249,5g ............. 63,5g
285g ............... x g
x = 72,5 gramas de cobre
Cálculo da massa de sal na amostra.
300g (amostra) ........... 100%
g (sal) ........................ 95%
x = 285gramas
Cálculo da massa molar do sal.
CuSO4. 5H2O = (63,5 .1) + (32 .1) + (16 .4) + (5 . 18) = 249,5gramas
Cálculo da massa de cobre, sabendo que 249,5 gramas do sal tem 63,5 gramas de cobre.
Sal ................. Cobre
249,5g ............. 63,5g
285g ............... x g
x = 72,5 gramas de cobre
 |
48) Certas ligas estanho-chumbo com composição específica forma um eutético simples, o que significa que uma liga com essas características se comporta como uma substância pura, com um ponto de fusão definido, no caso 183oC. Essa é uma temperatura inferior mesmo ao ponto de fusão dos metais que compõem esta liga (o estanho puro funde a 232ºC e e o chumbo puro a 320oC), o que justifica sua ampla utilização na soldagem de componentes eletrônicos, em que o excesso de aquecimento deve sempre ser evitado.
Uma liga metálica eutética com 64% de estanho e 36% de chumbo apresentará que densidade.
As densidades do estanho e do chumbo são 7,3 g/mL e 11,3 g/mL, respectivamente.
Cálculo da densidade da liga.
Resumo teórico
Densidade das ligas metálicas: é a média ponderada das densidades de cada metal, ou seja, é a soma dos produtos da densidade pela quantidade de cada metal na liga, dividida por 100.
Resolução do exercício
Leitura percentual: estanho 64% significa que em cada 100 partes da liga 64 partes são de estanho.
Leitura percentual: chumbo 36% significa que em cada 100 partes da liga 36 partes são de chumbo.
(64 x 7,3 + 36 x 11,3) / 100 = 8,74 é a densidade da liga
49) Calcule a massa de ácido nítrico puro em cada centímetro cúbico do ácido concentrado que possui 69,8% em massa de ácido nítrico puro e tem uma densidade de 1,42gramas por centímetro cúbico.
Resumo teórico
Ácido concentrado é uma mistura de ácido puro com pouca água.
Leitura percentual: 69,8% significa que 100gramas do ácido concentrado tem 69,8gramas do ácido puro.
Leitura da densidade: cada centímetro cúbico ocupado pelo ácido concentrado tem massa igual a 1,42gramas, que representa a soma da massa de ácido puro mais a massa de água que esta misturada.
Resolução do exercício
Precisamos calcular a massa de ácido puro(map) em um centímetro cúbico que apresenta massa de ácido concentrado(mac) igual a 1,42gramas.
mac ............. map
100g .......... 69,8g
1,42g .......... x
x = 0,991gramas de ácido puro
Método alternativo por Análise Dimensional
Em geral qualquer fator de conversão é igual a 1, podendo ser utilizado como multiplicador ou divisor de qualquer grandeza física. A escolha da multiplicação ou divisão depende do problema em questão.
Se no final das multiplicações e divisões não der a unidade desejada é por que houve alguma inversão durante o cálculo.
Neste caso como queremos a massa de ácido nítrico puro, precisamos simplificar a unidade gramas da massa do ácido nítrico concentrado, que corresponde a 100gramas e 1,42gramas.
50) O ácido utilizado em baterias tem uma densidade de 1,285g/cm3 e contém 38% em massa de ácido sulfúrico. Quantos gramas de ácido sulfúrico estão contidos em 1 litro de ácido para bateria.
Resumo teórico
1centímetro cúbico de ácido tem uma massa de 1,285gramas. Então, 1litro(1000cm3) tem uma massa de 1285gramas.
Resolução do exercício
1 cm3 ............... 1,285g
1000cm3 .......... x
x = 1285gramas
Se 38%, em massa, do ácido são de ácido sulfúrico puro, o número de gramas de ácido sulfúrico puro em 1 litro de ácido para bateria é:
1285g ............. 100%
x g ................. 38%
x = 488 gramas
Método alternativo por Análise Dimensional
Em geral qualquer fator de conversão é igual a 1, podendo ser utilizado como multiplicador ou divisor de qualquer grandeza física. A escolha da multiplicação ou divisão depende do problema em questão.
Se no final das multiplicações e divisões não der a unidade desejada é por que houve alguma inversão durante o cálculo.
Neste caso a associação 38gramas de ácido sulfúrico = 100gramas de ácido de bateria não é verdadeira, mas a associação de 38g de ácido sulfúrico para cada 100gramas de ácido de bateria é válida, pois uma grandeza implica na outra e esta relação foi originada da percentagem igual a 38% .






































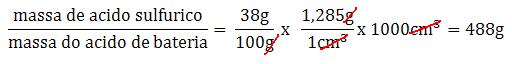
Nenhum comentário:
Postar um comentário